
科目: 来源: 题型:
【题目】某化学兴趣小组测定某过氧化氢溶液中过氧化氢的浓度,进行如下实验:取20.00mL的该过氧化氢溶液加水稀释至250.00mL,取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样.用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式为:2MnO ![]() +5H2O2+6H+═2Mn2++8H2O+5O2↑.据此作答:
+5H2O2+6H+═2Mn2++8H2O+5O2↑.据此作答:
(1)滴定时,将高锰酸钾标准溶液注入(填“酸式”或“碱式”)滴定管中;滴定到达终点的现象是: .
(2)配置标准溶液时使用的KMnO4固体中如果含有少量K2SO4杂质,则对测定结果的影响是 . (填“偏大”、“偏小”或“不变”)
(3)重复滴定四次,分别耗用c mol/LKMnO4标准溶液的体积为:0.99V mL、1.03V mL、1.28VmL、0.98V mL,则原过氧化氢溶液中的物质的量浓度为molL﹣1 .
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室制备1,2﹣二溴乙烷的反应原理如下:CH3CH2OH ![]() CH2=CH2 , CH2=CH2+Br2→BrCH2CH2Br.用少量的溴和足量的乙醇制备1,2﹣二溴乙烷的装置如图:
CH2=CH2 , CH2=CH2+Br2→BrCH2CH2Br.用少量的溴和足量的乙醇制备1,2﹣二溴乙烷的装置如图: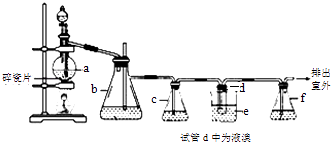
有关数据列表如下:
乙醇 | 1,2﹣二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/gcm﹣3 | 0.79 | 2.2 | 0.71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | ﹣130 | 9 | ﹣116 |
回答下列问题:
(1)在装置c中应加入(选填序号),其目的是吸收反应中可能生成的酸性气体.
①水 ②浓硫酸 ③氢氧化钠溶液 ④饱和碳酸氢钠溶液
(2)判断d管中制备二溴乙烷反应已结束的最简单方法是 .
(3)将二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在水的(填“上”或“下”)层.
(4)若产物中有少量未反应的Br2 , 最好用(填正确选项前的序号)洗涤除去.
①水 ②氢氧化钠溶液 ③碘化钠溶液 ④乙醇
(5)反应过程中需用冷水冷却(装置e),其主要目的是;但不用冰水进行过度冷却,原因是:
(6)以1,2﹣二溴乙烷为原料,制备聚氯乙烯,为了提高原料利用率,有同学设计了如下流程:1,2﹣二溴乙烷通过(①)反应制得(②),②通过( ③)反应制得氯乙烯,由氯乙烯制得聚氯乙烯.
①(填反应类型)②(填该物质的电子式)③(填反应类型)写出第一步的化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】有关Na2CO3和NaHCO3的叙述中正确的是( )
A. 相同质量的Na2CO3和NaHCO3与足量盐酸作用时,产生的气体质量相同
B. Na2CO3比NaHCO3热稳定性强
C. Na2CO3和NaHCO3均可与澄清石灰水反应
D. Na2CO3和NaHCO3均不可与NaOH溶液反应
查看答案和解析>>
科目: 来源: 题型:
【题目】将一定体积CO2气体通入到一定浓度的NaOH溶液中,向反应后溶液中滴加相关试剂,下列结论正确的是:( )
A. 逐滴滴加盐酸溶液,立即产生气泡,则生成物只含有NaHCO3
B. 逐滴滴加盐酸溶液,开始无气泡产生,则生成物一定含有Na2CO3
C. 加入BaCl2溶液,有白色沉淀,则可确定CO2和NaOH反应的离子方程式:CO2+2OH-==CO![]() +H2O
+H2O
D. 加入MgCl2溶液,有白色沉淀,则反应中NaOH溶液过量。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、X均为中学常见的纯净物,它们之间有如下转化关系(反应条件及副产物已略去)。
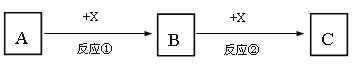
(1)若A、B、C均为含有同种非金属元素的化合物,A为使湿润的红色石蕊试纸变蓝的气体,B接触空气立刻变为C,则反应①的化学方程式为_______________________。
(2)若A、B、C为焰色反应均呈黄色的化合物,X为无色无味气体,则反应②的离子方程式为_____________________________________________。
(3)若A、B、C均为含有同种金属元素的化合物,X是强碱,则反应②的离子方程式为________________________________________________。
(4)若A为单质Fe,X为稀硝酸,则反应②的离子方程式为___________________;若向B的溶液中加入氢氧化钠溶液,现象为________________________________________,对应的化学方程式为___________________________________________。
(5)若A和X均为单质,B为可使品红溶液褪色的气体,则反应②的化学方程式为___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)研究SO2的性质对改善空气质量具有重要意义。某化学兴趣小组为探究SO2的化学性质进行以下实验,如下图装置(加热及固定装置已略去)。

①以上实验中,体现SO2具有氧化性的实验现象为____________,对应化学方程式为_____________________。
② D装置的作用是__________,写出该装置中发生的离子方程式______________。
③ A中反应开始后,试管B中始终无明显现象。现将试管B中溶液分成两份,分别滴加一定量的氯水和氨水,均出现白色沉淀,任选其中一个实验,结合离子方程式进行解释:_____________________________________________。
(2)硫酸工厂的烟气中含有SO2,有多种方法可实现烟气脱硫。
① “钠碱法”用NaOH溶液作吸收剂,向 100 mL 0.3 mol·L-1的NaOH溶液中通入标准状况下0.448 L SO2气体,所得溶液中的溶质是_________________________________(填化学式)。
② 某硫酸厂拟用含Cr2O72的酸性废水处理烟气中SO2,反应后的铬元素以Cr3+形式存在,则反应中氧化剂和还原剂的物质的量之比是__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关H2O的说法中,错误的是
A. 水在化学反应中能做氧化剂
B. 水既能与碱性氧化物反应,又能与酸性氧化物反应
C. 水在化学反应中能做还原剂
D. 过氧化钠与水反应时,每生成1molO2转移电子总数为2.408×1024
查看答案和解析>>
科目: 来源: 题型:
【题目】某校课外活动小组为了探讨铜与硝酸的反应设计了如下实验。
(1)甲同学欲探究铜与稀硝酸反应产生的气体主要是NO,设计装置如图所示(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是含有一半空气的注射器。
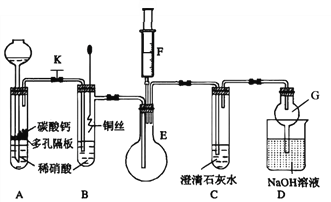
请回答有关问题:
①装置A中进行反应时打开止水夹K,当装置C中_________时,关闭止水夹K,试分析这样操作的目的是________,A中反应的离子方程式为______________。
②在完成①中的“操作”后,将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是__________________,B中反应的离子方程式为____________________。
③为进一步证明产物是NO,将注射器F中的空气推入E中,看到的现象是_________________。
④装置G的作用是_____________________。
(2)同学们发现铜与稀、浓硝酸反应所得溶液的颜色不同,并记录如下:
将1 g细铜丝放入盛有10 mL的1 mol·L-1 HNO3溶液的试管中加热 | 铜丝表面有无色气体逸出,溶液变为天蓝色 |
将1 g细铜丝放入盛有10 mL的14 mol·L-1HNO3溶液的试管中 | 产生大量红棕色气体,溶液变为绿色,绿色由深到浅,未见到蓝色 |
有同学认为是铜与浓硝酸反应的溶液中溶解了生成的气体,也有同学认为是溶液中剩余硝酸浓度较大所致,同学们分别设计了以下4个实验来判断该看法是否正确,以下方案中可行的是(选填序号字母)____________。
a. 向上述绿色溶液中通入氮气,观察颜色变化
b. 加水稀释上述绿色溶液,观察颜色变化
c. 向饱和的硝酸铜溶液中不断滴加14 mol·L-1HNO3溶液
d. 向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com