
科目: 来源: 题型:
【题目】某研究性学习小组请你参与“铁及其化合物”有关性质的实验探究,并共同解答下列问题:
探究一 设计如图所示装置进行“铁与水反应”的实验(夹持仪器略)。
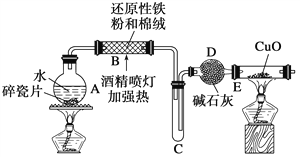
(1)硬质玻璃管B中发生反应的化学方程式为_______________________________。
(2)反应前A中投放碎瓷片的目的是____________________。
(3)装置E中的现象是__________________________________。
探究二 FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol·L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、玻璃棒、胶头滴管外还需的玻璃仪器是________。
(2)下列有关配制过程中说法正确的是________(填序号)。
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色。某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+。
(3)请你完成下表,验证假设
实验步骤、预期现象 | 结论 |
①向溶液中加入__________,振荡、静置, 现象:下层呈橙红色,上层呈无色 | 假设1正确 |
②向溶液中加入_____________ 现象:溶液变为红色 | 假设2正确 |
若假设1正确,从实验①中分离出Br2的实验操作名称是_______________ 。
(4)已知:Br2+2Fe2+=2Fe3++2Br-。若在50mL上述FeBr2溶液中通入标准状况112mlCl2,反应的离子方程式为__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列5个有机化合物中,能够发生酯化、加成和氧化3种反应的是( )
①CH2=CHCOOH
②CH2=CHCOOCH3
③CH2=CHCH2OH
④CH3CH2CH2OH
⑤ ![]()
A.①③④
B.②④⑤
C.①③⑤
D.①②⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】下列表述正确的是( )
A.氧化铁是一种碱性氧化物,常用作红色油漆和涂料
B.在医疗上碳酸钠、氢氧化铝均可用于治疗胃酸过多
C.Na2O2与水反应,红热的Fe与水蒸气反应均能生成碱
D.人造刚玉熔点很高,可用作高级耐火材料,主要成分是SiO2
查看答案和解析>>
科目: 来源: 题型:
【题目】在标准状况下,相同质量的下列气体,占有体积由大到小的顺序是① Cl2② H2③ N2④ CO2⑤ O2
A.③②④⑤①B.⑤②④③①
C.①④⑤②③D.②③⑤④①
查看答案和解析>>
科目: 来源: 题型:
【题目】已知NO2和N2O4可以相互转化:2NO2(g)N2O4(g)△H<0.在恒温条件下将一定量NO2和N2O4的混合气体通入一容积为2L的密闭容器中,反应物浓度随时间变化关系如图.下列说法不正确的是( ) 
A.图中的两条曲线,X表示NO2浓度随时间的变化曲线
B.前10 min内用v(N2O4)=0.02 mol/(Lmin)
C.25 min时,NO2转变为N2O4的反应速率增大,其原 因是将密闭容器的体积缩小为1L
D.该温度下反应的平衡常数 K=1.11 L/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s)CO2(g)+Cu(s)和反应②:H2(g)+CuO(s)Cu(s)+H2O(g)在相同温度下的平衡常数分别为K1和K2 , 该温度下反应③:CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数为K.则下列说法正确的是( )
A.反应①的平衡常数K1= ![]()
B.反应③的平衡常数K= ![]()
C.对于反应③,恒容时,若温度升高,H2的浓度减小,则该反应的焓变为正值
D.对于反应②,恒温恒容时,若加入CuO,平衡向正向移动,H2的浓度减小
查看答案和解析>>
科目: 来源: 题型:
【题目】碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病.碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶于水.碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质碘.以碘为原料,通过电解制备碘酸钾的实验装置如图所示. 
请回答下列问题:
(1)碘是物质,实验室常用方法来分离提纯含有少量杂质的固体碘.
(2)写出碘酸钾在酸性介质中与过氧化氢反应的离子方程式:
(3)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区.另将氢氧化钾溶液加入阴极区,电解槽用水冷却.图中的序号3应为离子交换膜(填“阳”或“阴”);电解时,阳极上发生反应的电极反应式为 .
(4)教材中利用KI与空气的反应来探究反应速率与温度的关系,现有1mol/L的KI溶液、0.1mol/L的H2SO4溶液、淀粉溶液,则实验时这几种试剂的加入顺序为:KI溶液、、;反应的离子方程式为 .
(5)已知KI+I2KI3 , 将I2溶于KI溶液,在低温条件下,可制得KI3H2O.该物质作为食盐加碘剂是否合适?(填“是”或“否”),并说明理由 . 为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失.下列物质中有可能作为稳定剂的是 . A.Na2S2O3B.AlCl3C.Na2CO3D.NaNO2 .
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示实验装置进行SO2性质的探究实验. 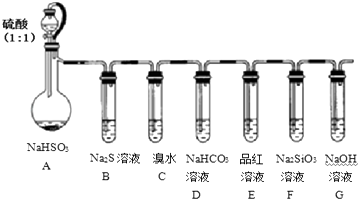
(1)装置A中发生反应的离子方程式为: , G装置的作用 .
(2)简述检查该装置气密性的方法 .
(3)能够证明SO2具有还原性、氧化性的实验装置依次为和(用字母表示),观察到的现象依次是、 .
(4)若要证明酸性:H2CO3>H2SiO3 , 则应观察到的实验现象有 .
(5)某同学用32gCu与50g 98%浓硫酸反应来制取SO2 , 实验结束后,还有19.2g的Cu剩余,若要让Cu完全溶解,则至少应加入1mol/L的稀硝酸mL.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com