
科目: 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3﹣)已成为环境修复研究的热点之一.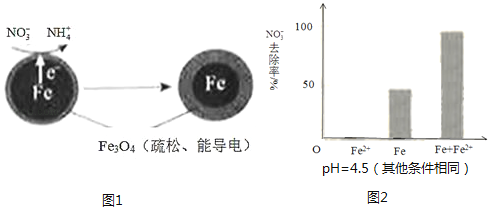
(1)Fe还原水体中NO3﹣的反应原理如图1所示.
①作负极的物质是 .
②正极的电极反应式是 .
(2)将足量铁粉投入水体中,经24小时测定NO3﹣的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3﹣的去除率低.其原因是 .
(3)实验发现:在初始pH=4.5的水体中投入足量铁粉的同时,补充一定量的Fe2+可以明显提高NO3﹣的去除率.对Fe2+的作用提出两种假设:
Ⅰ.Fe2+直接还原NO3﹣;
Ⅱ.Fe2+破坏FeO(OH)氧化层.
①做对比实验,结果如图2所示,可得到的结论是 .
②同位素示踪法证实Fe2+能与FeO(OH)反应生成Fe3O4 . 结合该反应的离子方程式,解释加入Fe2+提高NO3﹣去除率的原因: .
(4)其他条件与(2)相同,经1小时测定NO3﹣的去除率和pH,结果如表:
初始pH | pH=2.5 | pH=4.5 |
NO3﹣的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3﹣去除率和铁的最终物质形态不同的原因: .
查看答案和解析>>
科目: 来源: 题型:
【题目】水杨酸某酯E的合成路线如图所示: 
已知:①2RCH2CHO ![]() R﹣
R﹣ ![]()
②A分子中只含有1个甲基;③D的相对分子质量为130;
(1)C中含氧官能团的名称为;反应④的反应方程式为;
(2)在合成路线中,设计⑤和⑦的目的;
(3)X是B的最简单同系物,请写出X与足量银氨溶液反应的离子方程式;
(4)下列有关说法正确的是;
a.B中有4种不同的氢
b.水杨酸与足量NaHCO3反应生成 ![]()
c.D不与金属钠反应
d.1mol E与氢气加成,最多消耗4mol H2
(5)H有多种同分异构体,其中能同时满足下列条件的共有种(不考虑立体异构)
①能发生银镜反应;②能发生水解反应;③能与FeCl3溶液发生显色反应,其中有5种氢,且氢的个数比为1:1:2:2:2的为(写结构简式).
查看答案和解析>>
科目: 来源: 题型:
【题目】为了充分应用资源,用工业废碱液(Ca(OH)2、NaOH)与烟道气(回收成分SO2)来制取石膏(CaSO42H2O)和过二硫酸钠(Na2S2O8)。设计简要流程如图:
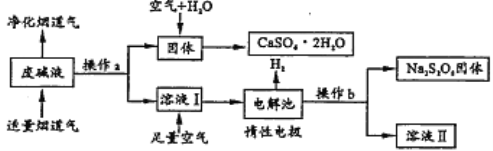
(1)烟道气中SO2与废碱生成沉淀的化学方程式为_____;操作a的名称是_____。
(2)生成CaSO42H2O过程中没有涉及到的化学反应类型为_____(填序号)。
A.复分解反应 B.化合反应 C.分解反应 D.氧化反应 E.置换反应
(3)溶液Ⅰ通入空气发生反应的化学方程式为_____。
(4)用惰性电极电解时,阳极生成Na2S2O8的电极反应为_____;在整个流程中可以循环利用的物质是H2O和_____(填化学式)。
(5)一定条件下将S8(s)、O2(g)、NaOH(s)转化过程中的能量关系用如图简单表示。则S8(s)燃烧的热化学反应方程式为_____。

(6)若制取ag Na2S2O8时,阳极有bL氧气(标况)产生。则电解生成的H2体积在标准状况下为_____L。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
A | B | C | D | |
强电解质 | Fe | CaCO3 | NaCl | HNO3 |
弱电解质 | CH3COOH | H3PO4 | NH3 | Fe(OH)3 |
非电解质 | 蔗糖 | 酒精 | BaSO4 | Al2O3 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】把一定质量的镁、铝混合物投入到1 mol/L的盐酸中,待金属完全溶解后,向溶液中加入1mol/L的氢氧化钠溶液,生成沉淀的质量与加入氢氧化钠溶液的体积关系如图所示。则:
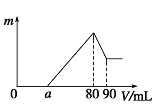
(1)金属铝的质量为_________;
(2)图像中80-90mL之间发生的离子方程式:____。
查看答案和解析>>
科目: 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料.通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450﹣500℃),四氯化硅经提纯后用氢气还原可得高纯硅.以下是实验室制备四氯化硅的装置示意图.
查阅相关资料获悉:
a.四氯化硅遇水极易水解;
b.铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
c.有关物质的物理常数见下表:
物质 | SiCl4 | AlCl3 | FeCl3 | PCl5 |
沸点/℃ | 57.7 | ﹣ | 315 | ﹣ |
熔点/℃ | ﹣70.0 | ﹣ | ﹣ | ﹣ |
升华温度/℃ | ﹣ | 180 | 300 | 162 |
请回答下列问题:
(1)写出装置A中发生反应的离子方程式 .
(2)装置A中g管的作用是;装置C中的试剂是;装置E中的h瓶需要冷却理由是 .
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,含有铁、铝等元素的杂质.为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+ , 再用KMnO4标准溶液在酸性条件下进行氧化还原反应滴定,锰元素被还原为Mn2+ . ①写出用KMnO4滴定Fe2+的离子方程式:;
②滴定前是否要滴加指示剂?(填“是”或“否”),判断滴定终点的方法是 .
③某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml试样溶液,用1.000×10﹣2molL﹣1KMnO4标准溶液滴定.达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是 . 若滴定前平视,滴定后俯视KMnO4液面,对测定结果有何影响(填“偏高”、“偏低”、或“无影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】我国化工专家侯德榜的“侯氏制碱法”曾为世界制碱工业做出了突出贡献.他以NaCl、NH3、CO2等为原料先制得NaHCO3 , 进而生产出纯碱.有关反应的化学方程式为:NH3+CO2+H2O=NH4HCO3;
NH4HCO3+NaCl=NaHCO3↓+NH4Cl;
2NaHCO3 ![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(1)碳酸氢铵与饱和食盐水反应,能析出碳酸氢钠晶体的原因是a.碳酸氢钠难溶于水
b.碳酸氢钠受热易分解
c.碳酸氢钠的溶解度相对较小,所以在溶液中首先结晶析出
(2)某探究活动小组根据上述制碱原理,进行碳酸氢钠的制备实验,同学们按各自设计的方案实验.①一位同学将二氧化碳气体通入含氨的饱和食盐水中制备碳酸氢钠,实验装置如下图所示(图中夹持、固定用的仪器未画出).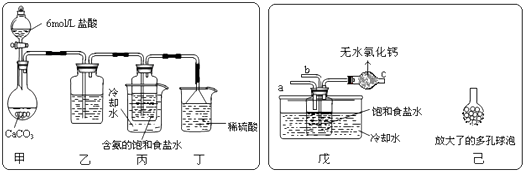
试回答下列有关问题:
(Ⅰ)乙装置中的试剂是;
(Ⅱ)丁装置中稀硫酸的作用是;
(Ⅲ)实验结束后,分离出NaHCO3 晶体的操作是(填分离操作的名称).
②另一位同学用图中戊装置(其它装置未画出)进行实验.
(Ⅰ)实验时,须先从管通入气体,再从管中通入气体;
(Ⅱ)有同学建议在戊装置的b管下端连接己装置,理由是;
(3)请你再写出一种实验室制取少量碳酸氢钠的方法: .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列操作不能达到目的是( )
选项 | 目的 | 操作 |
A | 配制100mL1.0molL﹣1CuSO4 | 将25.0gCuSO45H2O溶于蒸馏水配成100mL溶液 |
B | 除去KNO3固体中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 |
C | 检验溶液是否含有SO | 取少量待测液于试管中,加入硝酸酸化的Ba(NO3)2溶液 |
D | 检验溶液中是否含有NH | 取少量溶液于试管中,加入NaOH后,加热,在试管口放置一片湿润的红色石蕊试纸 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】肉桂酸异戊酯( ![]() )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下: 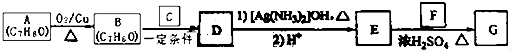 已知以下信息:
已知以下信息:
① ![]() ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22.
回答下列问题:
(1)A的化学名称为 .
(2)B和C反应生成D的化学方程式为 .
(3)F中含有官能团的名称为 .
(4)E和F反应生成G的化学方程式为 , 反应类型为 .
(5)F的同分异构体中不能与金属钠反应生成氢气的共有种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为写结构简式).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com