
科目: 来源: 题型:
【题目】运用化学反应原理知识研究如何利用CO、SO2等污染物有重要意义.
(1)用CO可以合成甲醇.已知:
①CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣764.5 kJmol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣764.5 kJmol﹣1
②CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0 kJmol﹣1
O2(g)=CO2(g)△H=﹣283.0 kJmol﹣1
③H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.8 kJmol﹣1
O2(g)=H2O(l)△H=﹣285.8 kJmol﹣1
则CO(g)+2H2(g)CH3OH(g)△H=kJmol﹣1
下列措施中能够增大上述合成甲醇反应的反应速率的是(填写序号).
a.使用高效催化剂 b.降低反应温度
c.增大体系压强 d.不断将CH3OH从反应混合物中分离出来
(2)在一定压强下,容积为V L的容器中充入a mol CO与2a mol H2 , 在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图1所示. 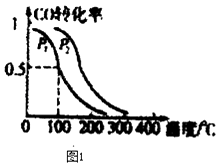
①p1p2(填“大于”、“小于”或“等于”);
②100℃时,该反应的化学平衡常数K=;
③100℃时,达到平衡后,保持压强P1不变的情况下,向容器中通入CO、H2号 CH3OH各0.5amol,则平衡(填“向右”、“向左”或“不”移动)
④在其它条件不变的情况下,再增加a mol CO和2a molH2 , 达到新平衡时,CO的转化率(填“增大”、“减小”或“不变”).
(3)在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数如图所示.在T1﹣T2及T4﹣T5两个温度区间,容器内甲醇的体积分数的变化趋势如图2所示,其原因是 . 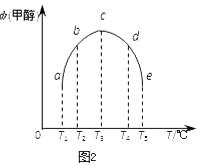
查看答案和解析>>
科目: 来源: 题型:
【题目】化学反应原理对化学反应的研究具有指导意义.
(1)298K,101KPa时,在1L水中可溶解0.09mol氯气,实验测得溶于说的氯气约有 ![]() 与水反应,该反应的离子方程式为,在上述平衡体系中加入少量NaHCO3固体,溶液中c(H+),c(Cl﹣)(填“增大”、“减小”、“不变”)
与水反应,该反应的离子方程式为,在上述平衡体系中加入少量NaHCO3固体,溶液中c(H+),c(Cl﹣)(填“增大”、“减小”、“不变”)
(2)用水稀释0.1mol/L氨水,溶液中随着水量的增加而增大的是(填字母)
a.c(OH﹣) b.c(NH3H2O) c.c(NH4+)c(OH﹣)
d.NH3H2O的电离程度 e.溶液的导电性
当溶液适当升高温度(不考虑NH3H2O分解和NH3逸出),上述数据增大的是;在溶液中加入少量NH4Cl固体(不考虑溶液温度变化),上述数据增大的是;当加入少量NaOH固体(不考虑溶液温度变化),上述数据增大的是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】教材中用酸性KMnO4溶液和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如图一和表: 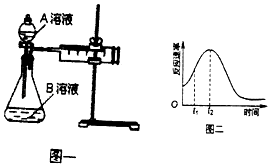
实验序号 | A溶液 | B溶液 |
① | 20 mL 0.1 molL﹣1H2C2O4溶液 | 30 mL 0.01 molL﹣1kMnO4溶液 |
② | 20 mL 0.2 molL﹣1 | 30 mL 0.01 molL﹣1KMnO4溶液 |
(1)用电离方程式表示草酸溶液显酸性的原因
(2)该实验探究的是因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是①②(填“>”“<”“=”)
(3)若实验①在2min末收集了896mL CO2(标准状况下),则用MnO4﹣表示该时间内的化学反应速率为v (MnO4﹣)= .
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定来比较化学反应速率.
(5)该实验小组同学发现反应速率如图二所示,其中t1~t2时间内速率变快的主要原因可能是:①该反应放热、② .
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生利用以下装置探究氯气与氨气之间的反应,其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气反应的装置。请回答下列问题:
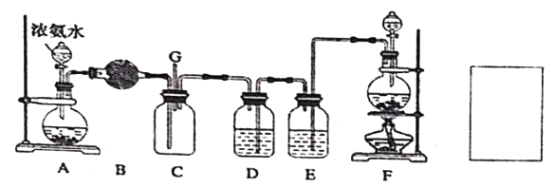
(1)装置F 为实验室制备氯气的装置,请写出实验室制备氯气的化学方程式________;
(2)装置A 中烧瓶内的固体可选用_____;装置B 中试剂可选用_____;
a.碱石灰 b.无水CuSO4 c.无水CaCl2 d.浓硫酸
(3)E 装置选用试剂的名称_____;
(4)装置C 内出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一。
①请写出反应的化学方程式______________;
②并用单线桥表示电子转移的方向和数目。
③当有amol氯气参加反应时,转移的电子总数为b 个,则阿伏加德罗数常数表示为______________;(用含a、b 的代数式表示,结果注明单位)
(5)通入C 装置的两根导管左边较长、右边较短,目的是______________;从装置C 的G 处逸出的尾气中可能含有黄绿色的有毒气体,请在上图右边方框中画图,表示处理该气体的方法,并标出气流方向和所用试剂的名称。_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】I、硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验并回答:
如图1所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c 三个棉球变化如下表(认为所产生的气体与棉球上的试剂均得到充分的反应)。则浓硫酸在该反应中表现的性质_________________;
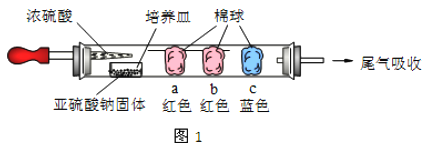
棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
a | ___________ | 棉球变白,微热后又恢复红色 | 该气体具有______性。 |
b | 含酚酞的NaOH 溶液 | 棉球变为白色 | 离子方程式_________ |
c | __________ | 棉球变为白色 | 化学方程式___________,该气体具有_______性。 |
II.通常情况下,向硫酸亚铁溶液中滴加氢氧化钠溶液时,生成的白色絮状沉淀会迅速变为_____色,最终变为____色写出上述白色絮状沉淀变化过程的化学方程式_______;
用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一: 用不含O2的蒸馏水配制的NaOH 溶液与硫酸亚铁反应制备。
(1)除去蒸馏水中溶解的O2常采用_________的方法。
(2)生成白色Fe(OH)2 沉淀的操作是用长滴管吸取不含O2的NaOH 溶液,插入FeSO4溶液液面下,再挤出NaOH 溶液。
方法二: 如右图装置中,用NaOH 溶液、铁屑、稀H2SO4等试剂制备。
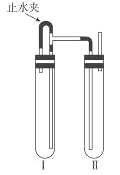
(1)在试管I里加入的试剂是___________。
(2)为了制得白色Fe(OH)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后,检验试管II出口处排出的氢气的纯度。当排出的氢气纯净时,再________(如何操作)。这样生成的Fe(OH)2 沉淀能较长时间保持白色。原因是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是( )

A. Mg2+、Al3+、Ba2+ B. H+、Mg2+、Al3+
C. H+、Cu2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCO3与砂搪混用可以作补血剂,实验室里制备FeCO3的流程如图所示。

下列说法错误的是
A. 降低温度防止NH4HCO3和FeSO4分解
B. 沉淀过程中有CO2气体放出
C. 过滤操作的常用玻璃仪器有烧杯、漏斗和玻璃棒
D. 产品FeCO3在空气中高温分解可得到纯净的FeO
查看答案和解析>>
科目: 来源: 题型:
【题目】将15.6g Na2O2和5.4g Al同时放入一定量的水中,充分反应后得到200mL溶液,再向该溶液中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确中缓慢通入标准状况下的HCl气体6.72L,若反应过程中溶液的体积保持不变,则下列说法正确的是( )
A. 标准状况下,反应过程中得到6.72L的气体
B. 最终得到的溶液中c(Na+)=c(Cl-)+c(OH-)
C. 最终得到7.8g的沉淀
D. 最终得到的溶液中c(Na+)=1.5mol·L-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各条件下可能共存的离子组是( )
A. 某无色溶液中: ![]() 、Na+、Cl-、
、Na+、Cl-、![]()
B. 由水电离出的c(H+)=1×10-13mol·L-1的溶液中:Na+、K+、![]() 、
、![]()
C. 在c(H+)=1×10-13 mol·L-1的溶液中: ![]() 、Al3+、
、Al3+、![]() 、
、![]()
D. 在pH=1的溶液中:K+、Fe2+、Cl-、![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于25μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系___(填“属于”,“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度(mol/L) | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断待测试样为___(填酸”、“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=_______mol/L。
(3)煤燃烧排放的烟气含有SO2和NOx,形成酸雨,污染大气,采用NaClO2溶液在碱性条件下可对烟气进行脱硫,脱硝,效果非常好。完成下列对烟气脱硝过程的离子方程式。
___ClO2-+__NO+____=___Cl-+___NO3-+___,________________
(4)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。写出焦炭与水蒸气反应的化学方程式___________。
②洗涤含SO2的烟气。以下物质可作洗涤剂的是___________。
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(5)汽车尾气中NOx和CO的生成及转化。
①汽车启动后,汽缸温度越高,单位时间内NO排放量越大,写出汽缸中生成NO化学方程式_______________。
②汽车燃油不完全燃烧时产生CO,目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com