
科目: 来源: 题型:
【题目】SO2气体为无色气体,有强烈刺激性气味,大气主要污染物之一,某学习小组为了探究二氧化硫的某些性质,进行了如下实验。
I.如下图所示,使用药品和装置一探究二氧化硫的还原性:
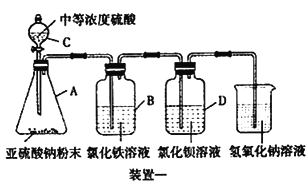
(1)装置C的名称为________。
(2)B中溶液的现象为________。
(3)学生甲预测装置D 中没有白色沉淀产生,但随着反应的进行,发现D 中产生了少量白色沉淀。学生乙经过查阅资料发现少量白色沉淀可能是硫酸钡,因为装置或溶液中少量的氧气参与了氧化反应,请写出装置D 中的反应方程式________。
II.经过思考,设计了如下装置二,且所配制的溶液均使用无氧蒸馏水,检验SO2 在无氧干扰时,是否与氯化钡反应生成沉淀。
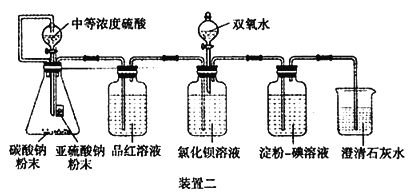
(4)碳酸钠粉末的目的是________。
(5)当______时,氯化钡溶液中没有沉淀出现,说明二氧化硫不与氯化钡溶液反应,此时滴加双氧水,出现了白色沉淀。
(6)裝置二选用澄清石灰水而不用氢氧化钠溶液的目的是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)标准状况下,1.12LCH4的质量为_______g。
(2)与3.2gSO2所含的O原子数相等的NO2的质量为_______g。
(3)配制500mL1.0mol·L-1CuSO4溶液时,在移液洗涤后,摇动容量瓶有少量液体溅出,则所配溶液物质的量浓变会_______(选填“偏高”、“偏低”、“无影响”)。
(4)把2.0mol·L-1Na2SO4溶液和1.0mol·L-1H2SO4溶液等体积混合(假设混合后溶液的体积为两者体积之和),则SO42-的物质的量浓度为_______mol·L-1。
(5)浓氨水可用于检验氯气管道是否漏气,其原理是8NH3+3Cl2=6NH4Cl+N2。该反应中氧化剂与还原剂的物质的最之比为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.质子核磁共振谱(PMR)是研究有机物结构的有力手段之一,在所研究的化合物分子中,每一结构中的等性氢原子在PMR谱中都给了相应的峰(信号),谱中峰的强度与结构中的H原子数成正比。例如,乙醛的结构式为CH3CHO,其PMR谱中有两个信号,其强度之比为3:1。已知有机物A的分子式为C4H8。
(1)若有机物A的PMR有4个信号,其强度之比为3:2:2:1,该有机物的名称为______。
(2)若该有机物PMR只有1个信号,则用结构简式表示为______。
II.“司乐平”是治疗高血压的一种临床药物,合成其有效成分的医药中间体为肉桂酸,其结构简式如图:![]() 。
。
(3)肉桂酸的分子式为_______,含有的含氧官能团名称为_______。
(4)一定条件下,1mol肉桂酸最多可与______molH2发生加成反应。
(5)肉桂酸的同分异构体,同时符合下列条件的结构简式为________。
①苯环上只有三个取代基
②能与新制氢氧化铜悬浊液反应生成砖红色物质
③质子核磁共振谐有4个信号,其强度之比为3:2:2:1
查看答案和解析>>
科目: 来源: 题型:
【题目】Q、X、Y、Z、W 五种元素的原子序数依次递增,W 为第四周期元素,其余均为短周期主族元素,已知:
①Q原子的最外层电子数是次外层电子数的2 倍
②Y、Z同主族,Y原子价电子排布图为![]() ;
;
③W元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子。
请回答下列问题:
(1)基态Q 原子中,电子运动状态有_____种,电子占据的最高能级符号为_____,该能级含有的轨道数为________。
(2)W的元素符号为_____,其基态原子的电子排布式为________。
(3)具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称为“等电子原理”,五种元素中电负性最强的非金属元素形成的一种单质A 与Y.Z 形成的化合物B 是等电子体物质,A、B分子式分别为______、_______。
(4)Q、X、Y三种元素的第一电离能数值最大的是_____(用元素符号作答),原因是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图表示500℃时,X、Y、Z三种气体在容积固定的容器中反应,各物质的浓度随时间的变化情况.达到平衡后,改变压强,平衡不移动.下列说法中正确的是( ) 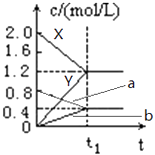
A.Z物质的变化情况为曲线b
B.该反应的化学方程式为:2X(g)3Y(g)+Z(g)
C.0→t1 , X的物质的量浓度变化量为1.2mol/L
D.若t1=1min,则v(Y )=0.02molL﹣1s﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)新制氯水在阳光照射下缓慢产生的无色气体为_______(填化学式)。
(2)氢氟酸若用玻璃试剂瓶盛装,发生的主要反应的化学方程式为_______。
(3)实验室常用Al2(SO4)3和NH3·H2O制备Al(OH)3其反应的离子方程式为_______。
(4)用玻璃棒蘸浓硫酸滴在火柴梗上,火柴梗变黑,浓硫酸表现出来的性质为_______。
(5)维生素C能将人体摄取的Fe3+转变为Fe2+,说明维生素C具有_______(选填“氧化性”或“还原性”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组在实验室进行硫的化合物系列实验。
Ⅰ.验证H2SO3的酸性比H2CO3强,甲同学设计下图装置。

(1)试剂X的作用是_______。
(2)当观察到_______,即证明H2SO3的酸性比H2CO3强。
Ⅱ.研究铁与硫酸的反应。
已知: 浓H2SO4的沸点为338.2℃。
a.乙同学设计如下表所示的实验1、2:
实验 | 试剂 | 现象 | |
| 1 | 螺旋状铁丝、稀硫酸 | 铁丝表面有大量气体产生。 |
2 | 螺旋状铁丝、浓硫酸 | 铁丝表面迅速发黑(Fe3O4),有少量气体产生,反应很快停止。 | |
(3)上述实验中,铁丝绕成螺旋状的目的是_______。
(4)实验1中,铁与稀硫酸反应的离子方程式为_______。
(5)实险2中的现象常被称为_______。
b.丙同学设计如图所示装置的实验3:
加热试管A,温度保持在250℃~300℃,产生大量气体,B中品红褪色,D处始终未检测到可燃性气体,实验结束后,检验到A的溶液中既有Fe3+又有Fe2+。
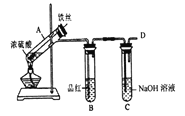
(6)A中产生的气体是_______; 请设计实验方案检测装置A的溶液中含有Fe3+_______ (简要说明操作、试剂、现象和结论)。
(7)分析实验1、2、3,可知影响铁和硫酸反应产物多样性的因素有_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室里有4个药品橱,已经存放以下物品:
药品橱 | 甲橱 | 乙橱 | 丙橱 | 丁橱 |
药品 | 盐酸,硫酸 | 氢氧化钠,氢氧化钙 | 红磷,硫 | 铜,锌 |
实验室新购进一些碘,应该将这些碘放在( )
A.甲橱B.乙橱C.丙橱D.丁橱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com