
科目: 来源: 题型:
【题目】下列装置应用于制取、干燥NH3、验证NH3还原性、吸收过量NH3并防止倒吸,其中能达到实验目的的是
A. 制取NH3  B. 干燥NH3
B. 干燥NH3 
C. 验证还原性 D. 吸收尾气
D. 吸收尾气
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、铝、铜等金属及其化合物在日常生活中应用广泛,请回答下列问题:
(1)单质铁属于晶体.黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料,其中一个反应为3FeS2+8O2 ![]() 6SO2+Fe3O4 , 氧化产物为 , 若有3molFeS2参加反应,转移mol电子.
6SO2+Fe3O4 , 氧化产物为 , 若有3molFeS2参加反应,转移mol电子.
(2)铝的价电子排布式为 , 明矾用作净水剂,其原理为(用离子方程式表示).
(3)金属Cu单独与氨水或单独与双氧水都不反应,但可与二者的混合溶液反应生成深蓝色溶液,Cu与氨水、双氧水反应的离子方程式;
(4)铁红是一种红色颜料,其成分是Fe2O3 , 将一定量的铁红溶于160mL5molL﹣1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24L氢气(标准状况),经检测溶液中无Fe3+ , 参加反应的铁粉的质量为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】离子方程式H+ + OH-= H2O可表示的化学方程式是( )
A. 盐酸与氢氧化铜的反应 B. 硫酸氢钠与氢氧化钠的反应
C. 硫酸与氢氧化镁的反应 D. 盐酸与氨水的反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的性质说法正确的是
A. 溶解度:Na2CO3>NaHCO3
B. 右图所示装置可证明稳定性:Na2CO3>NaHCO3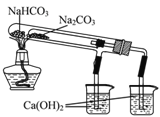
C. 用澄清石灰水可鉴别Na2CO3溶液和NaHCO3溶液
D. 等质量的Na2CO3和NaHCO3分别与过量盐酸反应,放CO2质量相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是利用工业冶炼硫酸铜(含有Fe2+、AsO2-、Ca2+等杂质)提纯制备电镀硫酸铜的生产流程。

已知:①Fe3+ Cu2+ 开始沉淀的pH分别2.7、5.4,完全沉淀的pH分别为3.7、6.4;
②KSP[(Cu(OH)2]=2×10-20
(1)溶解操作中需要配制含铜64g/L的硫酸铜溶液100L,需要称量冶炼级硫酸铜的质量至少为 Kg。
(2)氧化步骤中发生的离子反应方程式为①
②AsO2— + H2O2+ H+=H3AsO4 ③ H3AsO4+ Fe3+=FeAsO4↓+ 3H+
(3)若要检验调节pH后溶液的Fe3+是否除尽,方法是 ;氧化后需要将溶液进行稀释,稀释后的溶液中铜离子浓度最大不能超过 mol·L-1。
(4)固体I的主要成分除 FeAsO4外还有 ,操作I为
(5)利用以上电镀级硫酸铜作为电解质溶液,电解粗铜(含铁、银杂质)制备纯铜,写出阳极发生的电极反应方程式
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是
A. 无色透明溶液中: H+、Na+、MnO![]() 、SO
、SO![]()
B. 碱性溶液中:Na+、K+、SiO![]() 、NO
、NO![]()
C. 能溶解Al2O3的溶液中:Mg2+、Cu2+、HCO![]() 、Cl-
、Cl-
D. 含有Fe2+的溶液中:H+、Ca2+、NO![]() 、AlO
、AlO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】水中因含有机物而具有较高的化学耗氧量.常用酸性KMnO4氧化有机物测其含量.主要操作步骤如下: 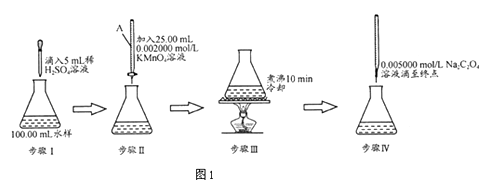
(1)仪器A为(填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为;
(2)完善步骤Ⅳ涉及的离子方程式:
C2O42﹣+MnO4﹣+H+═Mn2++CO2↑+;
该步骤中滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,其原因是
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00mL,已知滴定后的液面如图所示,请在图2中标出滴定前的液面. 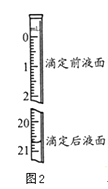
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl﹣影响
猜想2:配制Na2C2O4标液定容时;
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl﹣影响.(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液) .
资料卡片:
①有机质可HNO3被氧化
②AgCl不与酸性KMnO4溶液反应
③Ag2C2O4可被酸性KMnO4溶液氧化.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. Fe+CuSO4===FeSO4+Cu B. NH4HCO3![]() NH3↑+H2O+CO2↑
NH3↑+H2O+CO2↑
C. Cl2+H2O![]() HCl+HClO D. Fe2O3+3CO
HCl+HClO D. Fe2O3+3CO![]() 2Fe+3CO2
2Fe+3CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上消除氮氧化物的污染,可用如下反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=a kJ/mol 在温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得n(CH4)随时间变化数据如下表:下列说法不正确的是( )
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4) | 0.50 | 0.30 | 0.18 | … | 0.15 |
A.10 min内,T1时CH4的化学反应速率比T2时小
B.温度:T1<T2
C.a<0
D.平衡常数:K(T1)<K(T2)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com