
科目: 来源: 题型:
【题目】硫、铁的化合物有广泛的应用。
(1)过二硫酸铵(NH4)2S2O8可以看成双氧水的衍生物,H2O2分子中的两个H原子被—SO3H基取代后即为过二硫酸。
①(NH4)2S2O8中硫元素的化合价为_________;
②用过二硫酸铵溶液检测废水中的Mn2+,配平下面的离子反应:_____S2O82-+____Mn2++_____=____MnO4-+____SO42-+____。
(2)大苏打的成分是Na2S2O3·5H2O,常用于防毒面具中吸收氯气。若1 mol Na2S2O3完全反应,失去8mol电子。写出其水溶液吸收氯气的离子方程式______________。
(3)磁性材料A是由两种元素组成的化合物,某研究小组按如图所示流程探究其组成:
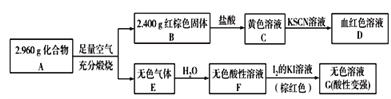
①已知化合物A能与盐酸反应,生成一种淡黄色不溶物和一种气体(标准状况下密度为1.518g/L),写出该反应的化学方程式:_______________________。
②已知25 ℃时,Ksp[Fe(OH)3]=8×10-39,该温度下反应Fe(OH)3+3H+![]() Fe3++3H2O的平衡常数为_________(列式并计算)。向0.001 mol/L FeCl3溶液中通入氨气(体积变化忽略不计),开始沉淀时溶液的pH为________。(lg 5=0.7)
Fe3++3H2O的平衡常数为_________(列式并计算)。向0.001 mol/L FeCl3溶液中通入氨气(体积变化忽略不计),开始沉淀时溶液的pH为________。(lg 5=0.7)
(4)①FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料,该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+FeS2![]() Fe+2Li2S,正极反应式是____。
Fe+2Li2S,正极反应式是____。
②FeSO4可转化为FeCO3,FeCO3在空气中加热会发生反应,可制得铁系氧化物材料。已知25 ℃、101 kPa时:4Fe(s)+3O2(g)![]() 2Fe2O3(s) ΔH=-1648 kJ.mol-1;C(s)+O2(g)=CO2(g)ΔH=-392 kJ·mol-1;2Fe(s)+2C(s)+3O2(g)
2Fe2O3(s) ΔH=-1648 kJ.mol-1;C(s)+O2(g)=CO2(g)ΔH=-392 kJ·mol-1;2Fe(s)+2C(s)+3O2(g)![]() 2FeCO3(s)ΔH=-1480 kJ·mol-1。FeCO3在空气中加热反应生成Fe2O3的热化学方程式是_______。
2FeCO3(s)ΔH=-1480 kJ·mol-1。FeCO3在空气中加热反应生成Fe2O3的热化学方程式是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机合成制药工业中的重要手段。G是某抗炎症药物的中间体,其合成路线如下:

已知:
 (具有还原性,极易被氧化)。
(具有还原性,极易被氧化)。
(1)B的结构简式为 ______。
(2)反应④的条件为 ___________ ;①的反应类型为 ____________ ;反应②的作用是_________ 。
(3)下列对有机物G的性质推测正确的是 __________(填选项字母)。
A.具有两性,既能与酸反应也能与碱反应
B.能发生消去反应、取代反应和氧化反应
C.能聚合成高分子化合物
D.1molG与足量NaHCO3溶液反应放出2molCO2
(4)D与足量的NaHCO3溶液反应的化学方程式为_______。
(5)符合下列条件的C的同分异构体有 _____种。
A.属于芳香族化合物,且含有两个甲基
B.能发生银镜反应
C.与FeCI3溶液发生显色反应
其中核磁共振氢谱有4组峰,且峰面积之比为6:2:2:1的是___(写出其中一种结构简式)
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻对位;苯环上有峰基时,新引入的取代基连在苯一平的间位。根据题中的信息,写现以甲苯为原料合成有机物(![]() )的流程图(无机试剂任选)________。合成路线流程图示例如下:
)的流程图(无机试剂任选)________。合成路线流程图示例如下: ![]() 目标产物。
目标产物。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图分别表示生物体内的生物大分子的部分结构模式图,据图回答下列问题:

(1)图甲中的三种物质的基本单位都是___________,其中属于动物细胞储能物质的是___________。这三种物质中,在功能上与另外两种截然不同的是______________________。
(2)图乙化合物是肺炎双球菌遗传物质的一部分,其基本单位是__________,可用图中字母_______表示,各基本单位之间是通过___________(填①、②或③)连接起来的。
(3)图丙所示化合物的名称是___________,是由___________种氨基酸经___________过程形成的,脱去水中的氢元素来自___________,连接氨基酸之间的化学键是___________(填化学键结构)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列哪种溶液中氯离子的物质的量浓度与50mL 0.5mol/L的氯化铝溶液中氯离子的物质的量浓度相同( )
A. 30mL 0.5mol/L的氯化镁溶液 B. 60mL 1.5mol/L的氯化钠溶液
C. 20mL 0.1mol/L的氯化钾溶液 D. 90mL 0.075mol/L 的氯化钙溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】如果反应4P + 3KOH + 3H2O === 3KH2PO2 + PH3中转移0.6mol电子,消耗KOH的质量为( )
A. 5.6克 B. 16.8克 C. 33.6克 D. 100.8克
查看答案和解析>>
科目: 来源: 题型:
【题目】某实验小组同学用如图所示装置设计实验,检验碳与浓硫酸反应的产物。
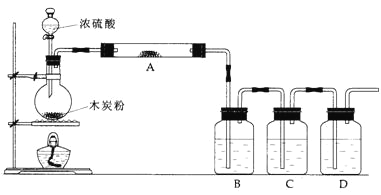
(1)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:___________。
(2)仪器A中应加入的试剂是______,作用是____________。
(3)仪器B中应加入的试剂是_____,作用是________。
(4)该实验小组在C中加入过量的酸性KMnO4溶液,D中加入澄清的石灰水,可根据__________现象判断产物中存在CO2气体。C中发生反应的离子方程式为:__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:周期表中前四周期的六种元素A、B、C、D、E、F核电荷数依次增大,其中A原子核外有三个未成对电子:化合物B2E的晶体为离子晶体,E原子核外的M层中有两对成对电子:C元素是底壳中含量最高的金属元素:D单质的熔点在同周期元素形成的单质中是最高的:F2+离子核外各层电子均充满。请根据以上信息,回答下列问题:
(1)A、B、C、D的第一电离能由小到大的顺序为______(用元素符号表示)
(2)B的氯化物的熔点比D的氯化物的熔点高,理由是______。
(3)E的最高价氧化物分子的空间构型是______。是______分子(填“极性”“非极性”)
(4)F原子的价层电子排布式是_____。
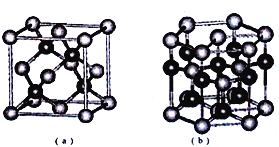
(5)E、F形成某种化合物有如图所示两种晶体结构(深色球表示F原子)。其化学式为_____。(a)中E原子的配位数为______,若在(b)的结构中取出一个平行六面体作为晶胞,则平均一个晶胞中含有_____个F原子。结构(a)与(b)中晶胞的原子空间利用率相比,(a)________(b)(填“>”“<”或“=”)
查看答案和解析>>
科目: 来源: 题型:
【题目】某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:

根据以上信息,回答下列问题:
(1)写出①中反应生成气体A的离子方程式:___________________________________
(2)上述离子中,溶液X中除H+外还肯定含有的离子是_______________,不能确定是否含有的离子是___________________,若要确定其中阳离子的存在,最常见的操作方法是____________(用文字表述)。
(3)沉淀G的化学式为_________,写出生成沉淀I的离子方程式_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列物质均为常见物质或它们的溶液,其中A为淡黄色固休,C、X均为无色气体,Z为浅绿色溶液,D为一种常见的强碱.根据它们之间的转化关系(如图),用化学用语回答问题。(部分产物已省略)

(1)写出下列物质的化学式:A_______ D__________
(2)A与SO3(g)的反应类似于A与X的反应,请写出A与SO3(g)反应的化学方程式并标出该反应电子转移的方向和数目:____________________________________。
(3)物质E转化为物质F的现象为___________________________________________,化学方程式为____________________________________________。
(4)向含10gD的溶液中通入一定量的X,完全反应后,在低温条件下蒸发结晶,最终得到14.8g固体。所得固体中含有的物质及其物质的量之比为_____________。 (表达示例:n(A)︰n(B)=a︰b);简述蒸发结晶在低温条件下进行的理由:___________(用必要文字回答)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com