
科目: 来源: 题型:
【题目】合成聚丙烯腈纤维的单体是丙烯腈,它可由以下两种方法制备:
方法一:CaCO3﹣→CaO ![]() CaC2
CaC2 ![]() CH≡CH
CH≡CH ![]() CH2═CH﹣CN
CH2═CH﹣CN
方法二:CH2═CH﹣CH3+NH3+ ![]() O2
O2 ![]() CH2═CH﹣CN+3H2O
CH2═CH﹣CN+3H2O
对以上两种途径的分析中,正确的是( )
①方法二比方法一反应步骤少,能源消耗低,成本低
②方法二比方法一原料丰富,工艺简单
③方法二比方法一降低了有毒气体的使用量,减少了污染
④方法二需要的反应温度高,耗能大.
A.①②③
B.①③④
C.②③④
D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中一定能大量共存的是
A.强酸性溶液:K+、HCO3、Br、Ba2+
B.滴加酚酞溶液显红色的溶液:Fe3+、NH4+、Cl、NO3
C.强酸性溶液:Cu2+、Na+、Mg2+、SO42
D.含有大量HCO3的溶液:Na+、NO3、Cl、OH
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列判断正确的是
A. 0.1 mol Na2O2含有的离子总数为0.4NA
B. 常温常压下,18g H2O 所含的中子数为8NA
C. 5.6 g铁与足量盐酸反应转移的电子数为0.3NA
D. 将含0.l mol FeCl3的饱和溶液制成胶体后,生成的Fe(OH)3胶粒数目为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】锰及其化合物在现代工业及国防建设中具有十分重要的意义。回答下列问题:
(1)常用铝热法还原软锰矿(主要成分为MnO2)来制金属锰。因为铝与软锰矿反应剧烈,所以先在强热条件下将软锰矿转变为Mn3O4,然后再将其与铝粉混合。
①MnO2中Mn的化合价为____________________。
②铝粉与Mn3O4反应时,还原剂与氧化剂的物质的量之比为_________________。
(2)pH=0的溶液中,不同价态锰的微粒的能量(E)如图所示。若某种含锰微粒(如Mn3+)的能量处于相邻价态两种微粒(Mn2+和MnO2)能量连线的上方,则该该微粒不稳定,会发生歧化反应,转化为相邻价态的微粒。

①MnO42-______(填“能”或“不能”)稳定存在于pH=0的溶液中。
②实验室可利用以下反应检验Mn2+的存在:2Mn2++5S2O82-+8H2O==16H++10SO42-+2 MnO42-,确认Mn2+存在的现象是______________________;检验时必须控制Mn2+的浓度和用量,否则实验失败,理由是___________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】结构为 ![]() 的有机物可以通过不同的反应得到下列四种物质
的有机物可以通过不同的反应得到下列四种物质
①  ②
② ![]() ③
③ ![]() ④
④ ![]() ,
,
生成这四种有机物的反应类型依次为( )
A.取代反应、消去反应、酯化反应、加成反应
B.取代反应、消去反应、氧化反应、取代反应
C.酯化反应、取代反应、缩聚反应、取代反应
D.酯化反应、消去反应、取代反应、氧化反应
查看答案和解析>>
科目: 来源: 题型:
【题目】实验是进行化学研究的重要手段之一。请回答下列问题:
(1)实验室需要450 mL 1 mol·L-1硫酸溶液。
①配制1 mol·L-1的硫酸时,下列仪器肯定不需要的是_________(填标号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器有________________。
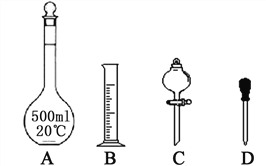
②在容量瓶的使用方法中,下列操作正确的是_______(填写序号)。
a.使用容量瓶前检验是否漏水
b.容量瓶用水洗净后,再用待配溶液洗涤
c.配制硫酸溶液时,用量筒量取浓硫酸后用玻璃棒引流注入容量瓶中,然后加水。
(2)如图装置中,若A中盛有品红溶液,B中盛有氢氧化钠溶液。
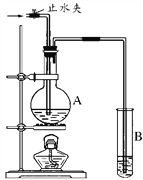
①向A中通入足量的SO2气体,然后加热,A中的现象_____________。
②向A中通入足量的Cl2气体,然后加热,A中的现象是_____________。
③若将SO2和Cl2按1:1体积比(同温同压)同时通入A中,则溶液不褪色。原因是SO2和Cl2在溶液中发生了氧化还原反应,且SO2被氧化,该反应的离子方程式是______________________。
(3)若(2)中的A中盛的是浓硫酸,加入足量的锌后,关闭止水夹并加热,进入B溶液的气体的化学式为____________;B中发生反应的离子方程式__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】制取物质、探究物质的性质是学习化学必备的素养之一。
回答下列问题。
(1)实验室从含碘废液(除水外含CCl4、I2、I-等)中回收碘,其实验流程如下。

回答下列问题:
①物质X的名称为________;
②操作Ⅰ选用的装置为______(填标号);

③含碘废液中加入稍过量的Na2SO3溶液将I2还原为I-,反应的离子方程式为___。
④氧化剂Y可用Cl2,也可以用H2O2。将同物质的量的I-转化为I2,所需Cl2和H2O2的物质的量之比为________。
(2)某研究小组查阅资料知:氧化性的强弱顺序为:Cl2>IO3->I2。用如图装置对Cl2与KI溶液的反应进行探究,发现通入Cl2一段时间后,KI溶液变为黄色,继续通入Cl2,则溶液黄色变浅,最后变为无色。

①NaOH溶液的作用是______,反应的离子方程式为___________。
②溶液由黄色最后变为无色所发生反应的离子方程式为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】善于归纳元素及其化合物之间的转化关系,对学习元素化合物具有重要意义。回答下列问题:
(1)置换反应是中学常见基本反应类型之一。
①写出金属单质置换出非金属单质的离子反应方程式_____________;
②写出非金属单质置换出非金属单质的化学方程式_____________。
(2)“三角转化”是单质及其化合物之间相互转化中常见的转化关系之一。现有如图转化关系。

①若Z是一种能够与血红蛋白结合造成人体缺氧的气体。则a的名称为___________;
②若X是一种常见金属单质,a为一种含氧酸。Y转化为Z的离子方程式___________。
③若X是一种强碱,a是一种酸性氧化物。Z转化为Y的离子反应方程式____________;
(3)在下图的转化关系中,A、B、C、D、E为含有一种相同元素的五种物质。

①若A为淡黄色固体单质,则B→D的化学方程式为_____________;
②若A常温下为气体单质,收集气体B采用的方法为________;若将32 g铜投入稍过量的E的浓溶液中,产生气体的体积为11.2 L(STP),参加反应的硝酸的物质的量为_____;
查看答案和解析>>
科目: 来源: 题型:
【题目】材料与生产、生活和科技密切相关。回答下列问题:
(1)复合材料中往往一种材料作为基体,另一种材料作为增强剂。下列物质中属于复合材料的是_________(填标号)。
A.钢化玻璃 B.玻璃钢 C.钢筋混凝土 D.玻璃
(2)无机非金属材料与我们的生活联系密切。我国具有独立知识产权的电脑芯片“龙芯一号”填补了我国计算机史上空白,“龙芯一号”材料的化学式为______;传统的无机非金属材料在日常生活中有着广泛的运用。玻璃和水泥的生产中均用到的原料的名称是____,其中碳酸钠在玻璃熔炉中反应的化学方程式为____________。
(3)随着科学技术的发展,具有特殊结构、功能的新型无机非金属材料被研制出来。碳化硅陶瓷(SiC)是一种耐高温陶瓷,反应原理为SiO2+3C![]() SiC+2CO↑,氧化剂与还原剂的物质的量之比为________。
SiC+2CO↑,氧化剂与还原剂的物质的量之比为________。
(4)金属材料的应用更是广泛。①工业常用30%FeCl3溶液腐蚀绝缘板上铜箔,制造印刷电路板。腐蚀废液中含有Fe3+、Fe2+、Cu2+离子。当向腐蚀液中加入足量的Fe粉,一定不存在的离子是_________;用实验判定腐蚀液中含有Fe2+离子_____________。
②某硬铝合金中含有铝、镁、铜、硅,下图为测定硬铝合金中铝的含量的流程图:

由溶液Ⅰ生成溶液Ⅱ中的溶质的离子方程式为__________________;该合金中铝的含量为_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com