
科目: 来源: 题型:
【题目】(1)为了制取纯净干燥的气体A,可用下图所示装置,生成A的速度可通过滴入液体B的速度控制。

①若A是能使带火星的木条复燃的气体,C物质是淡黄色粉末,且不需要Ⅲ装置,则A是______(填化学式),写出烧瓶中发生反应的化学方程式并用双线桥法标出电子得失情况:________________。
②若A可以灭火,C为块状不溶性固体,则A物质是________(填化学式,下同),D物质是__________,烧瓶中发生反应的的离子方程式为_____________________________________。
(2)某学生若用上图所示装置,一次实验即可确定HCl、H2CO3、H2SiO3的酸性强弱(不必选其他酸性物质),则E中发生反应的的离子方程式为__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)NH3的摩尔质量为__________,3.4g NH3的物质的量为__________mol,该气体在标准状况下的体积为___________L。
(2)相同质量的O2和SO2,所含分子的数目之比为_____________,所含氧原子的物质的量之比为______________。
(3)实验室需要0.10 mol/L的硫酸980mL,某同学欲用密度为1.84 g/cm![]() 、溶质的质量分数为98%的浓硫酸进行配制,需量取98%浓硫酸的体积为__________mL,若向容量瓶转移溶液时,有少量液体溅出,则会使所配制的溶液物质的量浓度___________(填“偏高”,“偏低”或“不变”)。
、溶质的质量分数为98%的浓硫酸进行配制,需量取98%浓硫酸的体积为__________mL,若向容量瓶转移溶液时,有少量液体溅出,则会使所配制的溶液物质的量浓度___________(填“偏高”,“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】加碘盐的主要成分是NaCl,还添加了适量的KIO3。下列说法中正确的是 ( )
A. KIO3和NaCl为离子化合物,均只含离子键
B. KIO3中阳离子的结构示意图为![]()
C. 23Na37Cl中质子数和中子数之比是8∶7
D. 次碘酸的结构式为H—O—I
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯硅是现代信息、半导体和光伏发电等产业都需要的基础材料。工业上提纯硅有多种路线,其中一种工艺流程示意图及主要反应如下:

下列说法正确的是 ( )
A. 自然界中存在大量的单质硅
B. 步骤电弧炉中的化学方程式为SiO2+C![]() Si+CO2↑
Si+CO2↑
C. 二氧化硅能与氢氟酸反应,而硅不能与氢氟酸反应
D. SiHCl3(沸点33.0 ℃)中含有少量的SiCl4(沸点67.6 ℃),通过蒸馏(或分馏)可提纯SiHCl3
查看答案和解析>>
科目: 来源: 题型:
【题目】孔雀石的主要成分为Cu2(OH)2CO3,还含少量FeO、Fe2O3、SiO2。以下是实验室以孔雀石为原料制备CuSO4·5H2O晶体的流程图:

(1)试剂A的化学式为_____________;固体b的化学式为______________。
(2)生成气体X的化学方程式为_________________________________。
(3)已知:有关金属离子从开始沉淀到沉淀完全时溶液的pH如表所示
Fe3+ | Cu2+ | Fe2+ | |
开始沉淀的pH | 2.7 | 5.1 | 8.1 |
沉淀完全的pH | 3.0 | 6.7 | 9.6 |
加入足量双氧水的目的是___________________________________(用离子方程式表示)。设计实验方案证明加入的双氧水已足量_____________________________________(实验方案包括试剂、现象和结论)。
(4)① 试剂B的使用是为了调节溶液的pH,使Fe3+转化为沉淀予以分离。试剂B可选用__________________。
A.NaOH溶液 B. Cu C.CuO D.Cu2(OH)2CO3
② 为完全除去溶液c中的Fe3+而又不使Cu2+沉淀,则应调节溶液pH的范围为________________。
(5)操作Ⅱ包括__________________、洗涤、干燥。
查看答案和解析>>
科目: 来源: 题型:
【题目】关于用CCl4萃取碘水的 说法中不正确的是
A. 碘在CCl4中的溶解度大于在水中的溶解度
B. 萃取后水层颜色变浅
C. 萃取后CCl4溶液层为紫色
D. 萃取后水层颜色变红且在下层
查看答案和解析>>
科目: 来源: 题型:
【题目】已知硫代硫酸钠溶液与稀H2SO4反应可析出单质硫沉淀:Na2S2O3+H2SO4=Na2SO4+S↓+SO2↑+H2O,某同学按下表进行实验,请你判断哪一组先出现浑浊。
编号 | 加3%Na2S2O3/mL | 加1∶5的H2SO4/滴 | 温度/℃ |
① | 5 | 25 | 25 |
② | 5 | 15 | 35 |
③ | 5 | 25 | 45 |
查看答案和解析>>
科目: 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式: .
(2)H3PO2中,磷元素的化合价为 .
(3)NaH2PO2是正盐还是酸式盐?其溶液显性(填弱酸性、中性、或者弱碱性).
(4)H3PO2也可以通过电解的方法制备.工作原理如图所示(阳膜和阴膜分别只允许阳离子,阴离子通过):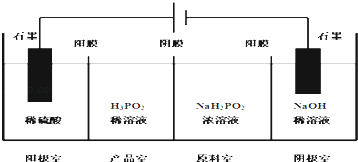
①写出阴极的电极反应式 .
②分析产品室可得到H3PO2的原因 .
③早期采用“三室电渗析法”制备H3PO2 , 将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是杂质.该杂质产生的原因是: .
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为﹣285.8kJmol﹣1、﹣283.0kJmol﹣1和﹣726.5kJmol﹣1 . 请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是kJ.
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为 .
(3)在容积为2L的密闭容器中,由CO2和H2合成甲醇,在其他条件不变得情况下,考察温度对反应的影响,实验结果如图所示(注:T1、T2均大于300℃).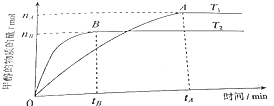
判断该可逆反应达到化学平衡状态的标志是(填字母).
①.v生成(CH3OH)=v消耗(CO2) ②.混合气体的密度不再改变
③.CO2、H2、CH3OH的浓度均不再变化 ④.混合气体的压强不再改变
(4)在直接以甲醇为燃料电池中,电解质溶液为酸性,负极的反应式为、正极的反应式为 . 理想状态下,该燃料电池消耗1mol甲醇所能产生的最大电能为702.1kJ,则该燃料电池的理论效率为(燃料电池的理论效率是指电池所产生的最大电能与燃料电池反应所能释放的全部能量之比).
查看答案和解析>>
科目: 来源: 题型:
【题目】向含Na2CO3、NaAlO2的混合溶液中逐滴加入150 mL 1 mol·L-1HCl溶液,测得溶液中的某几种离子物质的量的变化如图所示,则下列说法不正确的是 ( )
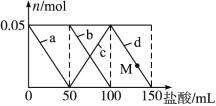
A. a曲线表示的离子方程式为:AlO2-+H++H2O ==Al(OH)3↓
B. b和c曲线表示的离子反应是相同的
C. M点时,溶液中沉淀的质量为3.9 g
D. 原混合溶液中的CO32-与AlO2-的物质的量之比为1∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com