
科目: 来源: 题型:
【题目】钼酸钠晶体(Na2MoO4·2H2O)常用于制造阻燃剂和无公害型冷水系统的金属抑制剂。下图是利用钼精矿(主要成分是MoS2,含少量PbS等)为原料生产钼酸钠晶体的工艺流程图:

回答下列问题:
(1)提高焙烧效率的方法有____________。(写一种)
(2)“焙烧”时MoS2转化为MoO3,该反应过程的化学方程式为________________________,氧化产物是________(写化学式)。
(3)“碱浸”时含钼化合物发生的主要反应的化学方程式为__________________________。
(4)若“除重金属离子”时加入的沉淀剂为Na2S,则废渣成分的化学式为________。
(5)测得“除重金属离子”中部分离子的浓度:c(MoO42-)=0.40mol/L,c(SO42-)=0.04mol/L。“结晶”前需先除去SO42-,方法是加入Ba(OH)2固体。假设加入Ba(OH)2固体后溶液体积不变,当SO42-完全沉淀(c(SO42-)≤1.0×10-5mol/L)时,BaMoO4是否会析出?____________________________________。(请计算说明)[已知:Ksp(BaSO4)=1.1×10-10,Ksp(BaMoO4)=4.0×10-8]
(6)钼精矿在碱性条件下,加入NaClO溶液,也可以制备钼酸钠,同时有SO42-生成,该反应的离子方程式为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某烃的含氧衍生物A能发生如下所示的变化.在相同条件下,A的密度是H2的28倍,其中碳和氢元素的质量分数之和为71.4%,C能使溴的四氯化碳溶液褪色,H的化学式为C9H12O4 . 
试回答下列问题:
(1)A中含氧官能团的名称;C的结构简式 .
(2)D可能发生的反应为(填编号);
①酯化反应 ②加成反应 ③消去反应 ④加聚反应
(3)写出下列反应的方程式①A与银氨溶液:;②G﹣H:;
(4)某芳香族化合物M,与A含有相同类型和数目的官能团,且相对分子质量比A大76.则:
①M的化学式为;
②已知M的同分异构体为芳香族化合物,不与FeCl3溶液发生显色反应,但能与Na反应,且官能团不直接相连.则M的同分异构体为(写1种): .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述不正确的是
A. 甲苯分子中所有原子在同一平面上
B. 苯、乙酸、乙醇均能发生取代反应
C. 分子式为C3H6Cl2的同分异构体共有4种(不考虑立体异构)
D. 可用溴的四氯化碳溶液区别![]() 和
和![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是
A. 氧化还原反应的本质是元素化合价的升降
B. 金属阳离子被还原后,一定得到金属的单质
C. 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来
D. 四氯化碳和水混合后,可用分液的方法来分离
查看答案和解析>>
科目: 来源: 题型:
【题目】“84消毒液”与硫酸溶液反应可以制取氯气,反应原理为:NaClO + NaCl + H2SO4 ![]() Na2SO4 + Cl2↑+ H2O; 为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置:
Na2SO4 + Cl2↑+ H2O; 为探究氯气的性质,某同学利用此原理制氯气并设计了如下所示的实验装置:
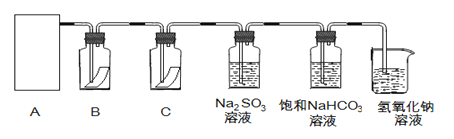
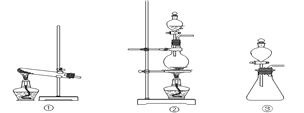
(1)从①、②、③装置中选择合适的制氯气装置(A处)___________ (填写序号)。
(2)装置B、C中依次放的是干燥的红色布条和湿润的红色布条,实验过程中该同学发现装置B中的布条也褪色,其原因可能是__________;说明该装置存在明显的缺陷,请提出合理的改进的方法 _______________________________。
(3)为了验证氯气的氧化性,将氯气通入Na2SO3溶液中,然后检验反应后溶液中是否含有SO42-。写出氯气与Na2SO3溶液反应的离子方程式 ________________,检验反应后溶液中含有SO42-的方法:取少量反应后溶液于试管中,先加入足量的_____至无明显现象,然后再加入少量____溶液有白色沉淀生成,说明含有SO42-。
(4)氯气通入饱和NaHCO3溶液能产生无色气体,已知酸性:盐酸>碳酸>次氯酸,该实验证明氯气与水反应的生成物中含有 ________________ (填“盐酸”或“次氯酸”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)漂白粉或漂粉精的有效成分是______(填化学式);
写出将氯气通入冷的消石灰中制取漂白粉的方程式____。
(2)![]() 的水溶液俗称_____,是制备硅胶和木材防火剂的原料。
的水溶液俗称_____,是制备硅胶和木材防火剂的原料。
(3)________是制造光导纤维的重要原料,生产普通玻璃和水泥都用到的原料是__。
(4)NO2是______色有毒气体,NO2与水反应的方程式为___________,标准状况下67.2L NO2与水反应转移电子______mol。
(5)中国的瓷器驰名世界,制备陶瓷是以黏土[主要成分Al2Si2O5(OH)4]为原料,经高温烧结而成。若以氧化物形式表示黏土的组成,应写为:________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】(一)某班同学用如下实验探究Fe2+、Fe3+的性质。回答下列问题:
(1)分别取一定量氯化铁、氯化亚铁固体,均配制成0.1 mol/L 的溶液。在FeCl2溶液中需加入少量铁屑,其目的是__________________________。
(2)甲组同学取2mLFeCl2溶液,加入几滴氯水,再加入1滴KSCN溶液,溶液变红,说明Cl2可将Fe2+氧化。FeCl2溶液与氯水反应的离子方程式为_______________。
(3)乙组同学认为甲组的实验不够严谨,该组同学在2mLFeCl2溶液中先加入0.5mL煤油,再于液面下依次加入几滴氯水和1滴KSCN溶液,溶液变红,煤油的作用是_____________。
(二)铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料.工业上提取氧化铝的工艺流程如下:

(1)沉淀A的成分是(填化学式)_________。
(2)步骤②中加入过量NaOH溶液发生反应的离子方程式,除了H++OH﹣=H2O还有:
_____________________________、________________________________;
(3)步骤③中通入过量CO2气体的离子方程式有______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硅单质化学性质不活泼,但常温下能与强碱溶液反应,下面几种含硅元素的物质之间的相互转化关系如图所示:

(1)写出图示反应的几种物质的化学式:
B____________,C____________,D________________。
(2)写出下列反应的化学方程式:
①B→A:_________________________________________________;
②B→E:______________________________________________________。
(3)写出下列溶液中反应的离子方程式:
D→C:___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】从环己烷可制备1,4﹣环己二醇二醋酸酯,下列过程是有关的8步反应(其中所有无机产物都已略去): 
(1)上述①~⑧8个步骤中属于取代反应的是(填序号,下同);属于消去反应的是;属于加成反应的是 .
(2)写出下列物质的结构简式:
B , C , D .
(3)写出下列反应的化学方程式:
② ;
⑤ ;
⑥ .
⑦ .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com