
科目: 来源: 题型:
【题目】下列叙述正确的是
A. NaHSO4水溶液能使石蕊变红,但NaHSO4不是酸
B. 有单质参加或有单质生成的反应一定是氧化还原反应
C. 酸性氧化物一定是非金属氧化物
D. 1molCl2的体积是22.4L
查看答案和解析>>
科目: 来源: 题型:
【题目】磷化铝(AlP)通常可作为一种广谱性熏蒸杀虫剂,吸水后会立即产生高毒性PH3气体(沸点-89.7℃,还原性强)。某化学兴趣小组的同学用下述方法测定粮食中残留磷化物的含量。

在C中加入l00g原粮,E中加入20.00mL l.50×l0-3 mol·L-1 KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。
回答下列问题:
(1)仪器D的名称是____________________________________。
(2)AlP与水反应的化学方程式为______________________________________________。
(3)装置A中盛装KMnO4溶液的作用是除去空气中的还原性气体,装置B中盛有焦性没食子酸的碱性溶液,其作用是__________________。
(4)通入空气的作用是_____________________________。
(5)装置E中PH3被氧化成磷酸,则装置E中发生反应的氧化剂和还原剂物质的量之比为___________________________。
(6)收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×l0-4 mol·L-1的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液15.00mL,Na2SO3与KMnO4溶液反应的离子方程式为:________________________________,则该原粮中磷化物(以PH3计)的含量为________________mg·kg-1(写计算表达式和计算结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】镍及其化合物在工业生产和科研领域有重要的用途。请回答下列问题:
(1)基态 Ni 原子中,电子填充的能量最高的能级符号为_________,价层电子的轨道表达式为_________。
(2)Ni的两种配合物结构如图所示:
A B
①A 的熔、沸点高于B的原因为_________。
②A晶体含有化学键的类型为___________(填选项字母)。
A.σ键 B.π键 C.配位键 D.金属键
③A晶体中N原子的杂化形式是_________。
(3) 人工合成的砷化镍常存在各种缺陷,某缺陷砷化镍的组成为Ni1.2As, 其中 Ni 元素只有+2 和+3 两种价态, 两种价态的镍离子数目之比为_________。
(4) NiAs的晶胞结构如图所示:

①镍离子的配位数为_________。
②若阿伏加德罗常数的值为NA,晶体密度为 ρ g·cm-3,则该晶胞中最近的砷离子之间的距离为_________pm。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y和Z在周期表中的相对位置如下表所示,这四种元素原子的最外层电子数之和为18。下列叙述正确的是
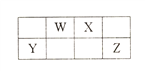
A. 氢化物的沸点:X<Z
B. 简单离子的半径:Y<X
C. 最高价氧化物对应水化物的酸性:Y>W
D. W与氢形成的所有化合物中的化学键均为极性共价键
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组利用以下装置探究氯气与氨气之间的反应。其中A、F分别为氨气和氯气的发生装置,C为纯净干燥的氯气与氨气发生反应的装置。回答下列问题:
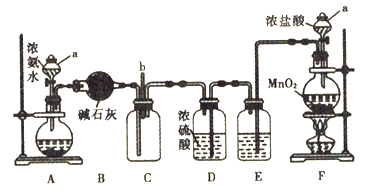
(1)仪器a的名称为______________。装置A的圆底烧瓶中盛放的固体物质可选用_______(填序号)
a.氯化钠 b.氢氧化钠 c.碳酸钙
(2)装置B、D的作用均为_____________________。从装置C的b处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有_____________溶液的洗气瓶。
(3)装置F的圆底烧瓶中发生反应的离子方程式为____________________________。装置E的作用是除去Cl2中的HCl,洗气瓶中盛 放的试剂为_________________________。
(4)反应过程中,装置C的集气瓶中有大量白烟产生,另一种产物为N2。该反应的化学方程式为___________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤气中主要的含硫杂质有H2S以及COS(有机硫),煤气燃烧后含硫杂质会转化成SO2从而引起大气污染,因此煤气中H2S的脱出程度已成为煤气洁净度的一个重要指标。请回答下列问题:
(1)H2S在水溶液中的电离方程式为___________。
(2)脱除煤气中COS的方法有Br2的KOH溶液氧化法、H2还原法、水解法等。
①COS的分子结构与CO2相似,COS的结构式为___________。
②Br2的KOH溶液将COS氧化为硫酸盐的离子方程式为______________。
③已知:H2、COS、H2S、CO的燃烧热依次为285kJ/mol、299kJ/mol、586kJ/mol、283kJ/mol;H2还原COS发生的反应为H2(g)+COS(g)=H2S(g)+CO(g),该反应的ΔH=_________kJ/mol。
④用活性α-Al2O3催化COS水解反应为COS(g)+H2O(g) ![]() CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。
CO2(g)+H2S(g) ΔH<0,相同流量且在催化剂表面停留相同时间时,不同温度下COS的转化率(未达到平衡)如图1所示;某温度下,COS的平衡转化率与n(H2O)/n(COS)的关系如图2所示。
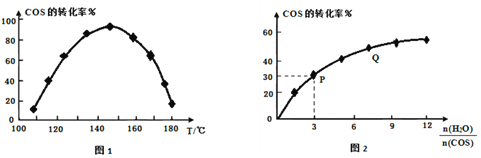
由图1可知,催化剂活性最大时对应的温度约为______,COS的转化率在后期下降的原因是_______________________________________。由图2可知,P点时平衡常数K=______(保留2位有效数字)。Q点转化率高于P点的原因是__________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,固定容积的密闭容器中,反应2SO2(g)+O2(g)![]() 2SO3(g),达到化学平衡状态的标志是
2SO3(g),达到化学平衡状态的标志是
①n(SO2):n(O2):n(SO3) =2:1:2 ②SO2的浓度不再发生变化 ③容器中的压强不变
④单位时间内生成nmolSO3,同时生成2nmolO2 ⑤混合气体的平均相对分子质量不变
A. ①④⑤ B. ①②④ C. ②③⑤ D. ①③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述错误的是
A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 如图所示实验可证明元素的非金属性:Cl>C>Si
C. 若X-和Y2-的核外电子层结构相同,则原子序数:X>Y
D. 在周期表中金属与非金属分界处的锗是一种优良的半导体材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com