
科目: 来源: 题型:
【题目】在恒温条件下起始时容积均为5L的甲、乙两密闭容器中(甲为恒容容器、乙为恒压容器),均进行反应:N2(g)+3H2(g)2NH3(g)△H2=﹣92.4kJ/mol,有关数据及特定平衡状态见表.
容器 | 起始投入 | 达平衡时 | |||
甲 | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 | |
乙 | amolN2 | bmolH2 | 0molNH3] | 1.2molNH3 | |
(1)若平衡后同种物质的体积分数相同,起始时乙容器通入的N2的物质的量为 ,
起始时乙中的压强是甲容器的倍,乙的平衡常数为
(2)恒容密闭容器中可以发生氨气的分解反应,达平衡后,仅改变下表中反应条件x,下列各项中y随x的增大而增大的是(选填序号).
选项 | a | b | c | d |
x | 温度 | 温度 | 加入H2的物质的量 | 加入氨气的物质的量 |
y | 混合气体的平均相对分子质量 | 平衡常数K | 混合气体的密度 | 达平衡时氨气的转化率 |
(3)研究在其他条件不变时,改变起始物氢气的物质的量对反应的影响,实验结果如图所示(图中T表示温度,n表示物质的量):
①像中T2和T1的关系是:T2T1(填“高于”“低于”“等于”“无法确定”).
②a、b、c三点中,N2转化率最高的是(填字母).
③若容器容积为1L,T2℃在起始体系中加入1mol N2 , 3molH2 , 经过5min反应达到平衡时H2的转化率为60%,则NH3的反应速率为 . 保持容器体积不变,若起始时向容器内放入2mol N2和6mol H2 , 达平衡后放出的热量为Q,则Q110.88kJ(填“>”、“<”或“=”).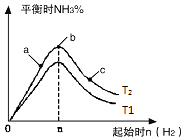
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,通过下列反应可实现燃煤烟气中硫的回收:
(1)SO2(g)+2CO(g)2CO2(g)+S(l)△H<0
①如果要提高上述反应的反应速率,可以采取的措施是 . (选填编号)
a.减压 b.增加SO2的浓度 c.升温 d.及时移走产物
②若反应在恒容的密闭绝热容器中进行,下列说法不正确的是 . (选填编号)
a.平衡前,随着反应的进行,容器内压强始终不变
b.当容器内温度不再变化时,反应达到了平衡
c.其他条件不变,升高温度可增大平衡常数
d.其他条件不变,使用不同催化剂,该反应热效应不同
③该反应的平衡常数表达式是′;某温度下2L恒定容器中加入2mol的SO2和2mol的CO.10分钟内,气体密度减小了8g/L,则CO的反应速率是 .
(2)SO2(g)+NO2(g)NO(g)+SO3(g)
①在2L恒定容器中加入2mol的SO2和2mol的NO2 , 达到平衡时测得SO2的转化率为50%,向该容器中再加入1mol的SO2 , 平衡将向方向移动,计算重新达到平衡时SO2的浓度是 , SO2的转化率由50%变为 , NO2的转化率由变为 .
②实验结果启示我们:增大一种反应物浓度,其转化率将(填增大、减小或不变),另一种反应物的转化率将 . 现实生产的意义是:可以通过增大的用量,来提高成本高的反应物的利用率.
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)请用下列10种物质的序号填空:
①O2 ②H2 ③NH4NO3 ④K2O2 ⑤Ba(OH)2 ⑥CH4 ⑦CO2 ⑧NaF ⑨NH3 ⑩I2
其中既有离子键又有非极性键的是________;既有离子键又有极性键的是________。
(2)X、Y两种主族元素能形成XY2型化合物,已知XY2中共有38个电子,若XY2为常见元素形成的离子化合物,其电子式为_________;若XY2为共价化合物时,其结构式为______。
(3)氯化铝的物理性质非常特殊,如:氯化铝的熔点为190℃,但在180℃就开始升华。据此判断,氯化铝是________(填“共价化合物”或“离子化合物”),可以证明你的判断正确的实验依据____________________。
(4)现有a~g7种短周期元素,它们在周期表中的位置如图所示,请据此回答下列问题:
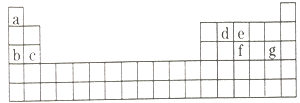
①元素的原子间反应最容易形成离子键的是________________。
A.c和f B.b和g C.d和g D.b和e
②写出a~g7种元素形成的所有原子都满足最外层为8电子结构的任意一种分子的分子式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:2NO2(红棕色)N204(无色)△H<0.将一定量的NO2充入注射器中后封口,如图是在拉伸和压缩注射器的过程中气体透光率随时间的变化(气体颜色越深,透光率越小).下列说法正确的是( ) 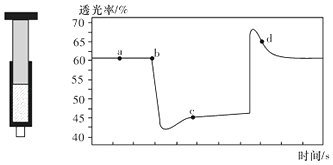
A.b点的操作是拉伸注射器
B.d点:v(正)>v(逆)
C.c点与a点相比,c(N02)增大,c(N204)减小,若容器绝热则平衡常数Ka>Kc
D.若不忽略体系温度变化,且没有能量损失,则T(b)<T(c)
查看答案和解析>>
科目: 来源: 题型:
【题目】元素铬及其化合物工业用途广泛,但含+6价铬的污水会损害环境,必须进行处理。某工厂的处理工艺流程如下:
![]()
(1)N2H4的电子式为___________。
(2)下列溶液中,可以代替上述流程中N2H4的是___________。(填选项序号)
A.FeSO4溶液 B.浓HNO3溶液 C.酸性KMnO4溶液 D.Na2SO3溶液
(3)已知加入N2H4的流程中,N2H4转化为无污染的物质,则该反应中氧化剂与还原剂的物质的量之比为___________。
(4)在实际的含铬废水处理中,还可采用直接沉淀的方法,处理成本较低。
①已知含铬酸性废水中存在着Cr2O72-和CrO42-相互转化的平衡,请用离子方程式表示它们之间的转化反应___________;
②在实际工业生产中,加入沉淀剂BaCl2溶液之前还要加入一定量的NaOH,这样有利于沉淀的生成,则生成的沉淀为____________写化学式)。
(5)工业上可用电解法来处理含Cr2O![]() 的酸性废水。具体方法是首先通过电解制得还原剂,然后还原剂将Cr2O
的酸性废水。具体方法是首先通过电解制得还原剂,然后还原剂将Cr2O![]() 还原为Cr3+,最终转化成Cr(OH)3沉淀而除去。如图为电解装置示意图(电极材料分别为铁和石墨)。
还原为Cr3+,最终转化成Cr(OH)3沉淀而除去。如图为电解装置示意图(电极材料分别为铁和石墨)。

①装置中b电极的材料是________(填“铁”或“石墨”)。
②上述处理过程中,Cr2O![]() 被还原成Cr3+的离子方程式为_______________________。
被还原成Cr3+的离子方程式为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。下图是某同学用0.1mol/L KOH 溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH 溶液滴定曲线示意图(混合溶液体积变化忽略不计)。下列有关判断不正确的是
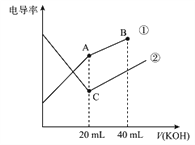
A. 曲线①代表0.1mol/L KOH 溶液滴定CH3COOH溶液的滴定曲线,曲线②代0.1mol/LKOH 溶液滴定HCl溶液的滴定曲线
B. 在相同温度下,C点水电离的c (H+) 大于A点水电离的c(H+)
C. 在A 点的溶液中有: c(CH3COO-)+c(OH-)-c (H+)=0.05mol/L
D. 在B 点的溶液中有: c(K+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目: 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是一种强还原剂。工业常用惰性电极电解亚硫酸氢钠的方法制备连二亚硫酸钠,原理装置如图所示,下列说法正确的是
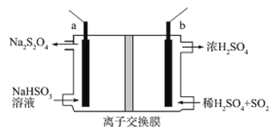
A. b电极应该接电源的负极
B. 装置中所用离子交换膜为阴离子交换膜
C. 电路中每转移1mole-消耗SO2的体积为11.2L
D. a电极的电极反应式为:2HSO3-+2e-+2H+=S2O42-+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】在密闭容器中,加热等物质的量的NaHCO3和Na2O2的固体混合物,充分反应后,容器中固体剩余物是( )
A. Na2CO3和Na2O2 B. Na2CO3和NaOH
C. NaOH和Na2O2 D. NaOH、Na2O2和Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A. 金属钠加入到CuSO4溶液中:2Na+Cu2+===Cu+2Na+
B. 将铝片打磨后置于NaOH溶液中:2Al+2OH-===2AlO![]() +H2↑
+H2↑
C. 向明矾溶液中加入过量的Ba(OH)2溶液:Al3++2SO![]() +2Ba2++4OH- === 2BaSO4↓+AlO
+2Ba2++4OH- === 2BaSO4↓+AlO![]() +2H2O
+2H2O
D. 向Ba(AlO2)2溶液中通入少量CO2:2AlO![]() +CO2+3H2O===2Al(OH)3↓+CO
+CO2+3H2O===2Al(OH)3↓+CO![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、D是由常见的短周期非金属元素形成的单质,常温下A是淡黄色粉末,B、D是气体,F、G、H的焰色反应均为黄色,水溶液均显碱性,E有漂白性。它们之间的转化关系如图所示(部分产物及反应条件已略去),回答下列问题:
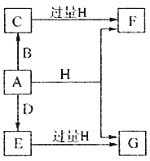
(1)A所含元素在周期表中的位置为______________,C的电子式为_______________。
(2)A与H在加热条件下反应的化学方程式为__________________。
(3)将A溶于沸腾的G溶液中可以制得化合物I,I在酸性溶液中不稳定,易生成等物质的量的A和E,I在酸性条件下生成A和E的离子方程式为____________________。I是中强还原剂,在纺织、造纸工业中作为脱氯剂,向I溶液中通入氯气可发生反应,参加反应的I和氯气的物质的量比为1:4,该反应的离子方程式为__________________。
(4)向含有0.4molF、0.1molG的混合溶液中加入过量盐酸,完全反应后收集到aL气体C(标准状况),取反应后澄清溶液,加入过量FeCl3溶液,得到沉淀3.2g,则a=____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com