
科目: 来源: 题型:
【题目】ClO2是一种国际上公认的安全无毒的绿色水处理剂。回答下列问题:
(1)工业废水的处理:某实验兴趣小组通过下图装置,利用稀硫酸、KClO3和草酸溶液制备ClO2,并用它来处理含Mn2+的工业废水。

①A装置的名称是______________,C装置的作用为__________________。
②B中反应产物有ClO2、CO2等,请写出该反应的化学方程式:___________________。
③写出装置D中除去Mn2+的离子方程式__________________。(已知Mn2+转化为MnO2)
(2)ClO2易溶于水。用水吸收ClO2得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了下列实验:
步骤1:准确量取ClO2溶液10.00mL,稀释成100.00mL试样:量取V1mL试样加入到锥形瓶中;
步骤2:调节试样的pH≤2.0,加入足量的KI晶体,静置片刻;
步骤3:加入淀粉指示剂,用cmol·L-1Na2SO3溶液滴定至终点,消耗Na2S2O3溶液V2mL。 (已知2Na2S2O3+I2=Na2S4O6+2NaI)
①滴定终点的判断依据是___________________。
②原ClO2溶液的浓度为_______________g/L(用步骤中的字母代数式表示)。
③若实验中使用的Na2S2O3标准溶液部分因被氧气氧化而变质,则实验结果___________(填“偏高”、“ 偏低”或“无影响”)
查看答案和解析>>
科目: 来源: 题型:
【题目】(14分)碳、氮、硫是中学化学重要的非金属元素,在工农业生产中有广泛的应用。
(1)用于发射“天宫一号”的长征二号火箭的燃料是液态偏二甲肼(CH3)2N-NH2,氧化剂是液态四氧化二氮。二者在反应过程中放出大量能量,同时生成无毒、无污染的气体。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,请写出该反应的热化学方程式________________________________________。
(2)298 K时,在2L的密闭容器中,发生可逆反应:
2NO2(g)![]() N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4(g) ΔH=-a kJ·mol-1(a>0)
N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题。

①298k时,该反应的平衡常数为________。
②在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示。下列说法正确的是

a.A、C两点的反应速率:A>C
b.B、C两点的气体的平均相对分子质量:B<C
c.A、C两点气体的颜色:A深,C浅
d.由状态B到状态A,可以用加热的方法
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d、e五个点,
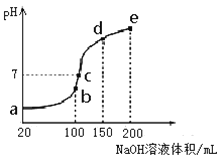
①水的电离程度最大的是__________;
②其溶液中c(OH-)的数值最接近NH3·H2O的电离常数K数值的是 ;
③在c点,溶液中各离子浓度由大到小的排列顺序是_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】U,W,Y是原子序数依次增大的短周期主族元素,在周期表中的相对位置如右表;U元素与氧元素能形成两种无色气体;W是地壳中含量最多的金属元素.
U | |||
W | Y |
(1)元素U的原子核外共有种不同能级的电子.
(2)能提高W与稀硫酸反应速率的方法是
a.使用浓硫酸 b.加热 c.加压 d.使用等质量的W粉末
(3)在恒容密闭容器中进行:2YO2(g)+O2(g) ![]() 2YO3(g)△H2=﹣190kJ/mol
2YO3(g)△H2=﹣190kJ/mol
①该反应 450℃时的平衡常数500℃时的平衡常数(填<,>或=).
②下列描述中能说明上述反应已达平衡的是
a.2ν(O2)正=ν(YO3)逆 b.气体的平均分子量不随时间而变化
c.反应时气体的密度不随时间而变化 d.反应时气体的分子总数不随时间而变化
③在一个固定容积为2L的密闭容器中充入0.20mol YO2和0.10molO2 , 半分钟后达到平衡,测得容器中含YO30.18mol,则ν(O2)=:平衡常数为 . 若继续通入0.20molYO2和0.10molO2 , 再次达到平衡后,YO3物质的量约为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】固体氢氧化钠必须密封保存的原因是( )
①氢氧化钠有毒 ②氢氧化钠有腐蚀性 ③氢氧化钠易吸收水分而潮解 ④氢氧化钠有挥发性 ⑤氢氧化钠能与空气中的二氧化碳反应
A.①②B.②③④C.②③⑤D.③⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义.
(1)已知: ![]() O2(g)═
O2(g)═ ![]() O2+(g)+
O2+(g)+ ![]() e﹣△H1=+587.9kJ/mol K1
e﹣△H1=+587.9kJ/mol K1
PtF6(g)+e﹣═PtF6﹣(g)△H2=﹣771.1kJ/mol K2
O2+PtF6﹣(s)═O2+(g)+PtF6﹣(g)△H3=+482.2kJ/mol K3
则反应O2(g)+PtF6(g)═O2+PtF6﹣(s)的△H= , K=(用K1、K2、K3表示)
(2)一定条件下,铁可以和CO2发生反应:Fe(s)+CO2(g)FeO(s)+CO(g),已知该反应的平衡常数K 与温度T 的关系如图甲所示. 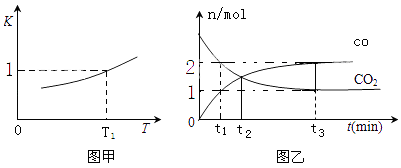
①T℃、p Pa压强下的密闭容器中进行反应,下列能说明反应达到平衡状态的是 .
a.混合气体的平均相对分子质量不再变化
b.容器内压强不再变化
c.v正(CO2)=v逆 (FeO)
d.CO2的体积分数不再变化
②T1温度下,向体积为VL的密闭容器中加入足量铁粉并充入一定量的CO2 , 达到平衡时则CO2的平衡转化率为;反应过程中体系的能量(增多或降低)
③T2温度下,恒容密闭容器中,反应过程中测定CO和CO2物质的量与时间的关系如图乙所示.则T1T2(填>、<或=),CO2的平衡转化率为 , 平衡时混合气体的密度与起始时气体的密度之比为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸是中学化学实验室的常见药品,回答下列问题:
I.配制一定物质的量浓度的硫酸溶液:
(1)某次实验大约需要1mol/L硫酸溶液435mL。同学们发现实验室内没有450mL的容量瓶,某同学提议用1个200mL容量瓶和1个250mL容量瓶来配制,你认为该提议______(填“合理”、“不合理”)。
(2)实验中要配制0.5mol/L H2SO4溶液250mL,则需量取密度为1.84g/mL、98%的浓硫酸________mL(结果保留小数点后一位)。
Ⅱ.蔗糖与浓硫酸的炭化实验会产生大量的有刺激性气味的气体,会对环境造成污染。 某实验小组利用如下装置对该实验进行改进。回答下列问题:

注:硬质玻璃管中①、②、③处分别为滴有Na2S溶液的滤纸、滴有品红溶液的滤纸、滴有酸性KMnO4溶液的滤纸,a和b分别为两个小气球。
(3)实验开始后先关闭活塞K,硬质玻璃管中①号试纸变黄,②号和③号滤纸均褪色,a处气球变大。硬质玻璃管中实验现象说明炭化实验产生的刺激性气味气体是 SO2,
①、②、③处发生的变化分别说明SO2具有_______、________和__________(填SO2表现出的性质)。
(4)SO2和Cl2均可以使品红溶液褪色,但将两种气体按体积比1:1混合通入品红溶液中,品红溶液不褪色,其原因是___________(用化学方程式回答)。
(5)打开活塞K, a处气球变小,b处气球变大。使三颈烧瓶内气体缓慢通过B瓶和C瓶,一段时间之后,发现澄清石灰水变浑浊。为证明有CO2生成,可以在④号位罝的滤纸滴加_______溶液,该试剂的作用是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上冶炼铝的原料是铝土矿(主要成分是Al2O3,杂质为Fe2O3、SiO2等)。某研究小组设计的提纯Al2O3的方案如下:

(1)滤渣a中除含泥沙外,一定含有____,分离溶液a和滤渣a的操作需要的玻璃仪器为__________________。
(2)溶液a中含铝元素的溶质与过量试剂A反应的离子方程式为_______________,溶液a与过量试剂A反应生成滤渣b的离子方程式为__________________。
(3)溶液b与过量试剂B反应生成滤渣c的离子方程式为_______________________。
(4)加热滤渣c得到氧化铝的操作需要使用的仪器除了酒精灯、三角架、泥三角,还有________(填主要仪器名称),实验室里还常往NaAlO2溶液中通入过量的_______来制取A1(OH)3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com