
科目: 来源: 题型:
【题目】乙烯是石油裂解气的主要成分,其产量通常用来衡量一个国家的石油化工水平。在一定条件下,有如下转化:

(1)乙烯的电子式是___________________。
(2)由重油生产乙烯的裂解反应属于_________________(填“化学”或“物理”)变化。
(3)乙烯转化为乙醇的反应类型是__________________。
(4)乙醇转化为A的化学方程式是____________________________________________。
(5)工业上乙烯通过聚合反应可得到高分子化合物B,反应的化学方程式是_____________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) △H=xkJ·mol-l
已知:①C(s)+O2(g)=CO2(g) △H=akJ·mol-l
②K2S(s)=S(s)+2K(s) △H=bkJ·mol-l
③2K(s)+N2(g)+3O2(g)=2KNO3(s) △H=ckJ·mol-l
下列说法正确的是
A. x>0 a<0
B. b<0 c<0
C. x=3a-b-c
D. 1mol 碳(s)在空气中不完全燃烧生成CO的焓变小于akJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】菠菜具有丰富的营养。民间流传:菠菜与豆腐不宜同时食用。
资料:(1)菠菜中含有可溶性草酸盐、碳酸盐等
(2)醋酸不与草酸钙反应
(3)某草酸钙晶体(CaC2O4·xH2O)的相对分子质量为128+18x
【实验一】菠菜中部分成分分析

(1)用开水煮沸菠菜样品碎末2~3 min的目的是___________________。
(2)溶液M中含有的主要阴离子有____________________。
(3)已知C能使澄清石灰水变浑浊。A与醋酸生成C的化学方程式是__________。
(4)B的化学式可能是________________。
(5)草酸比碳酸的酸性___________(填“强”或“弱”)。
【实验二】对某草酸钙晶体进行热分解研究,得到相关数据如图所示。

(1)800℃时得到的固体只含钙元素和氧元素,质量比为5:2,其化学式是__________。
(2)固体质量由12.8 g变为10.0 g的过程中发生反应的化学方程式是__________。
(3)x =_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学完成如下实验。
(1)实验记录(请补全表格中空格)
实验步骤 | 实验现象 | 离子方程式 |
| ①溶液分层 ②下层呈橙色。 | _____________ |
| ①溶液分层 ②__________ | Br2+2I-=I2+2Br- |
(2)该实验的目的是______________________。
(3)氯、溴、碘单质氧化性逐渐减弱的原因:同主族元素,最外层电子数相同,从上到下, _________,得电子能力逐渐减弱。
查看答案和解析>>
科目: 来源: 题型:
【题目】“西气东输”是西部开发的重点工程,这里的气体是指天然气,其主要成分是甲烷.工业上将碳与水在高温下反应制得水煤气,水煤气的主要成分是CO和H2 , 两者的体积比约为1:1.已知1mol CO气体完全燃烧生成CO2气体放出283kJ热量,1molH2完全燃烧生成液态水放出286kJ热量;1molCH4 气体完全燃烧生成CO2气体和液态水放出890kJ热量.
(1)写出H2完全燃烧生成液态水的热化学反应方程式: , 若1molCH4气体完全燃烧生成CO2气体和水蒸气,放出的热量 890kJ(填“>”、“=”或“<”)
(2)忽略水煤气中其它成分,相同状况下若得到相等的热量,所需水煤气与甲烷的体积比约为;燃烧生成的CO2 的质量比约为 .
(3)以上数据和计算说明,以天然气代替水煤气作民用燃料,突出的优点是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确( )
A. 可用pH试纸测新制氯水的pH
B. 工业上将氯气通入澄清石灰水制漂白粉,其有效成分是次氯酸钙
C. 漂白粉漂白时,向溶液中滴入少量稀盐酸或通入二氧化碳可以增强漂白效果
D. FeCl2既能由金属和氯气直接反应得到,又能由金属和盐酸反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在80℃时,将0.40mol的N204气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O42NO2 , 隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s一40s内用N2O4表示的平均反应速率为molL﹣1S﹣1;
(2)计算在80℃时该反应的平衡常数K=(请注明单位).
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”.“变深”或“不变”)
(4)要增大该反应的K值,可采取的措施有(填序号):
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线. 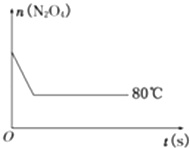
查看答案和解析>>
科目: 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. MgCO3![]() MgCl2(aq)
MgCl2(aq)![]() Mg
Mg
B. NaCl(aq)![]() NaHCO3
NaHCO3![]() Na2CO3
Na2CO3
C. Cu2(OH)2CO3![]() CuO
CuO![]() Cu(OH)2
Cu(OH)2
D. SO2![]() NH4HSO3
NH4HSO3![]() (NH4)2SO4
(NH4)2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室用图所示装置制备乙酸乙酯。

(1)实验前,向试管a中加入3 mL_____________,然后边振荡试管边慢慢加入2 mL____________和2 mL乙酸。
(2)试管a中生成乙酸乙酯的化学方程式是____________________。
(3)试管b中盛放的试剂是饱和__________________溶液。试管b中的导管不能伸入液面下的原因是_________________________。
(4)反应结束后,从试管b中分离出乙酸乙酯的方法是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据下列实验操作和现象所得到的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 测定等物质的量浓度的Na2CO3和Na2SO4溶液的pH,前者的PH比后者的大 | 元素非金属性:S>C |
B | 向盛有Fe(NO3)2溶液的试管中加入0.lmol.L-1H2SO4溶液,试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
C | 向FeBr2溶液中加入少量氯水,再加CCl4萃取,CCl4层无色 | Fe2+的还原性强于Br- |
D | 向溶液中滴加盐酸酸化的BaC12溶液,产生白色沉淀 | 溶液中一定含有SO42- |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com