
科目: 来源: 题型:
【题目】为探究Cl2、Br2、Fe3+的氧化性强弱,某化学兴趣小组设计了如下实验:

(1)①A是氯气发生装置,其反应的离子方程式是__________________________________。
②B装置的作用是_________________________,C装置的作用是_______________________,整套实验装置存在一处明显不足,请指出_______________________________________________________。
(2)用改正后的装置进行实验。实验过程如下:
实验操作 | 实验现象 |
打开活塞a,向圆底烧瓶中滴入少量浓盐酸,然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中: 振荡后水层溶液变黄,CCl4无明显变化 |
继续滴入浓盐酸,D、E中均发生了新的变化:
D装置中:红色慢慢褪去。E装置中:CC14层先由无色变为橙色,后颜色逐渐变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
I:(SCN)2 性质与卤素相似,氧化性Cl2大于(SCN)2,且SCN-的电子式为![]()
II:AgClO、AgBrO 均可溶于水
Ⅲ:Cl2 和Br2反应生成BrCl、BrCl呈红色,沸点约为5℃,与水发生水解反应
①小组同学认为D装置中红色褪去的原因是由于SCN-被Cl2氧化,但一定不是碳元素被氧化,他的理由是__________________________________________。
②经过实验证实了小组同学推测的合理性,请用平衡移动原理解释Cl2过量时D中溶液红色褪去的原因__________________________________________。
③欲探究E 中继续滴加浓盐酸后颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合化学用语解释仅产生白色沉淀的原因_________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某废催化剂含48.6% 的SiO2、16.2% 的ZnO、19.4% 的ZnS 和12 .8% 的CuS 及少量的Fe3O4。.某同学用10.0g该废催化剂为原料,回收锌和铜。采用的实验方案如下,回答下列问题:

已知:金属Zn 与Al类似,都是两性金属,能溶于强碱并放出氢气,但铝不溶于氨水,锌却可以溶于氨水形成四氨合锌配离子[Zn(NH3)4]2+。
(1)滤液1中含有Fe2+,选用提供的试剂进行检验,检验方法如下:__________________________。(提供的试剂:稀盐酸、KSCN 溶液、KMnO4 溶液、NaOH 溶液、K3[Fe(CN)6]溶液)
(2)滤渣2 除SiO2 外的另一成分是____________;第二次浸出时,加热温度不宜过高的原因是___________________;写出第二次浸出的化学反应方程式____________________________________。写出锌溶于氨水的离子方程式____________________________________。
(3)ZnSO4在水中的溶解度,随温度的升高而缓慢增大,从硫酸锌溶液得到七水硫酸锌晶体,可采用的方法是_____________________;析出七水硫酸锌晶体,减压过滤,用于淋洗七水硫酸锌晶体的溶剂是___________________;某同学在实验完成之后,得到5.74gZnSO4·7H2O(式量287)则锌的回收率为_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是:
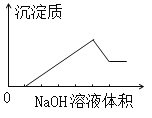
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目: 来源: 题型:
【题目】下列事实或现象与胶体性质无关的是
A. 三氯化铁溶液中加入NaOH溶液出现红褐色沉淀
B. 煮沸的FeCl3溶液冷却后,用一束光照射,有一条光亮的通路
C. 胶态金属氧化物分散于玻璃中制成有色玻璃
D. 江河入海口易形成三角洲
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的钠和铝的混合物与足量的水充分反应,没有金属剩余,收到2.24L气体,下列说法一定正确的是
A. 所得气体为氢气 B. 所得气体的物质的量为 0.1 mol
C. 上述过程只发生一个化学反应 D. 所得溶液中只有一种溶质
【答案】A
【解析】钠与水反应生成氢气,铝与氢氧化钠溶液反应生成氢气,所以所得气体为氢气,故A正确;非标准状况下,2.24L气体的物质的量不一定是 0.1 mol,故B错误;上述过程,发生钠与水反应生、铝与氢氧化钠溶液反应,共发生两个化学反应,故C错误;所得溶液中的溶质可能有偏铝酸钠和氢氧化钠两种溶质,故D错误。
点睛:铝能与酸反应放出氢气,铝也能与强碱溶液反应放出氢气,如![]() 。
。
【题型】单选题
【结束】
21
【题目】I.SO2是一种重要的化工原料,其合理利用以及废气处理一直是化工研究的热点。
(1)氧元素在元素周期表中位于第______周期______族,硫原子核外有_____种能量不同的电子。
(2)元素的非金属性S比O______(填“强”或“弱”),从原子结构的角度解释原因:__________。
II.工业上利用反应SO2 + MnO2 → MnSO4 可以制备高纯 MnSO4,实验装置如下图:

(3)请标出反应SO2 + MnO2 → MnSO4的电子转移方向和数目____________
(4)在通入干燥空气的条件下,一段时间后,测得反应后溶液中的 n(SO42-)明显大于 n(Mn2+),请说明原因: ___________________。用化学方程式表示石灰乳的作用: ___________________。
III.SO2可用于处理含 Cr2O72-(铬元素化合价为+6)的废水,最后转化为铬沉淀(铬元素化合价为+3)除去。一种处理流程如下:
![]()
(5)NaHSO3与 Cr2O72-反应时,物质的量之比为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是
A. 2.4 g金属镁与足量盐酸反应,转移电子的数目为0.1 NA
B. 1L 1 mol·L-1的CaCl2溶液中含Cl-的数目为NA
C. 在25℃、1.01×105Pa的条件下,2.24 L H2中含有的分子数小于0.1 NA
D. 22 g CO2与标准状况下11.2 L H2O含有相同的分子数
查看答案和解析>>
科目: 来源: 题型:
【题目】硫和钙的相关化合物在化工、医药、材料等领域有着广泛的应用。回答下列问题:
(1)钙元素的焰色反应呈砖红色,其中红色对应的辐射波长为___nm(填字母)。
A.435 B.500 C.580 D.605 E.700
(2)元素S和Ca中,第一电离能较大的是________(填元素符号),其基态原子外围电子排布式为________。其基态原子中电子的空间运动状态有________种。
(3)硫的最高价氧化物的水合物硫酸能与肼反应生成N2H6SO4,N2H6SO4晶体类型与硫酸铵相同,则N2H6SO4的晶体内不存在________ (填字母)。
A.离子键 B.共价键 C.配位键 D.范德华力
(4)基态Ca原子中,核外电子占据最高能层的符号是________, 该能层为次外层时最多可以容纳的电子数为________。钙元素和锰元素属于同一周期,且核外最外层电子构型相同,但金属钙的熔点、沸点等都比金属锰低,原因是________________________。
(5)过氧化钙晶体的晶胞结构如图所示,已知该晶胞的密度是ρg·cm-3,则晶胞结构中最近的两个Ca2+间的距离为______________________nm(列算式即可,用NA表示阿伏加德罗常数的数值)。与Ca2+紧邻O22-的个数为________。

查看答案和解析>>
科目: 来源: 题型:
【题目】CO2既是温室气体,也是重要的化工原料,二氧化碳的捕捉和利用是我国能源领域的一个重要战略方向。
(1)用活性炭还原法可以处理汽车尾气中的氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+ 2NO(g) ![]() N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) △H,在T1℃时,反应进行到不同时间测得各物质的量浓度如下:
浓度/(mol/L)/\时间/min | 0 | 10 | 20 | 30 | 40 |
NO | 2.0 | 1.16 | 0.40 | 0.40 | 0.6 |
N2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 1.2 |
①若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:3:3,则达到新平衡时NO的转化率______________(填“升高”或“降低”),△H_____0(填“>”或“<”)。
②根据图表数据分析T1℃时,该反应在0~10min内的平均反应速率v(N2)=______________mol·L-1·min-1;计算该反应的平衡常数K=_____________。
③若30min后只改变某一条件,据上表中的数据判断改变的条件可能是____________(填字母编号)。
A.加入合适的催化剂 B.适当缩小容器的体积
C.通入一定量的NO D.加入一定量的活性炭
(2)工业上用CO2和H2反应合成二甲醚。已知:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.1 kJ·mol-1
2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
CH3OCH3(g)+H2O(g) △H2=-24.5 kJ·mol-1
写出CO2(g)和H2(g)转化为CH3OCH3(g)和H2O(g)的热化学方程式_______________________。
(3)二甲醚燃料电池具有能量转化率高、电量大的特点而被广泛应用,一种二甲醚氧气电池(电解质为KOH溶液)的负极反应式为:_______________________。
(4)常温下,用NaOH溶液作CO2捕捉剂不仅可以降低碳排放,而且可得到重要的化工产品Na2CO3。
①若某次捕捉后得到pH=10 的溶液,则溶液中c(CO32-)∶c(HCO3-)=_______________。[常温下K1(H2CO3)=4.4×10-7、 K2(H2CO3)=5×10-11]。
②欲用2LNa2CO3溶液将4.66gBaSO4 固体全都转化为BaCO3,则所用的Na2CO3溶液的物质的量浓度至少为__________________________。[已知:常温下Ksp(BaSO4)=1×10-11,Ksp(BaCO3)=1×10-10]。(忽略溶液体积的变化)
查看答案和解析>>
科目: 来源: 题型:
【题目】下列两个热化学方程式中,△H1 和△H2的相对大小正确的是( ) S(s)+O2(g)=SO2(g)△H1; S(g)+O2(g)=SO2(g)△H2 .
A.△H1>△H2
B.△H1<△H2
C.△H1﹦△H2
D.无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】测定NaOH和Na2CO3的混合液中的NaOH含量时,可先加过量的BaCl2溶液,使Na2CO3完全变成BaCO3沉淀,再用标准盐酸滴定(用酚酞作指示剂),试回答:
(1)向混有BaCO3沉淀的NaOH溶液中滴入盐酸,为什么不会使BaCO3沉淀溶解而能测定NaOH的含量?答: .
(2)滴定时,若滴定管中滴定液一直下降到活塞处才打到滴定终点,则能否由此准确地计算出结果?答: .
(3)能否改用甲基橙作指示剂?答: , 若用甲基橙作指示剂,则测定结果如何?答:(填“偏高”、“偏低”和“无影响”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com