
科目: 来源: 题型:
【题目】金属镍具有优良的物理和化学特性,是高技术产业的重要原料.
羰基法提纯镍涉及的反应为:Ni(s)+4CO(g)Ni(CO)4(g)
①当温度升高时, ![]() 减小,则△H0(填“>”或“<”).
减小,则△H0(填“>”或“<”).
②一定温度下,将一定量的粗镍和CO加入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是(填代号)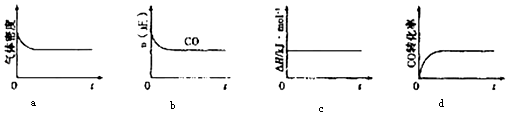
在相同温度下,上述反应改在体积为1L的恒容密闭容器中进行,平衡常数(填“增大”、“不变”或“减小”),反应进行3s后测得Ni(CO)4的物质的量为0.6mol,则0﹣3s内的平均反应速率v(CO)= .
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室分离或提纯下列各组物质时,应选用下列哪种主要仪器?(填字母)
![]()
![]()
![]()
(1)分离CCl4和H2O:_________;
(2)除去澄清石灰水中悬浮的CaCO3:_________;
(3)从含少量KNO3的NaCl溶液中提取NaCl:_________;
(4)分离乙酸(沸点为118℃)与乙酸乙酯(沸点为77.1℃)的混合物:_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】将Cl2制成漂白粉的最主要目的是:①使它转变成较易溶于水的物质 ②转变成较稳定、便于贮存的物质 ③提高氯的质量分数 ④提高漂白能力
A.①②③B.②④C.②③D.②
查看答案和解析>>
科目: 来源: 题型:
【题目】在25℃时,对于0.1molL﹣1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 ![]() 将(填“增大”、“减小”或“不变”);
将(填“增大”、“减小”或“不变”);
(2)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1:1,此时溶液的pH7(填“大于”、“小于”或“等于”),用离子方程式表示其原因 , 此时溶液中各离子浓度由大到小的顺序为 .
(3)若向氨水中加入0.05molL﹣1稀硫酸至溶液正好呈中性,所用氨水的体积V1与稀硫酸的体积V2的关系为V1V2(填“大于”、“小于”或“等于”),写出溶液中各离子浓度之间满足的电荷守恒表达式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组利用硝酸和废铜屑(含Cu和CuO)作为原料制备硝酸铜,设计的流程如下:
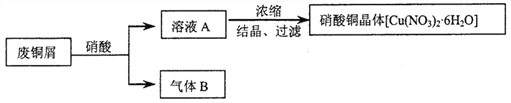
(1)某次实验使用了废铜屑共24g,用一定浓度的硝酸100mL完全溶解这些废铜屑时,共收集到标准状况下B气体6.72L(其中NO2和NO的体积比为2∶1)。请通过计算回答下列问题:
①废铜屑中铜和氧化铜的物质的量之比_____________。
②若测得溶液A中H+的浓度为1mol·L-1,则原硝酸的物质的量浓度为________________。(假设反应前后溶液的体积不变)
(2)上述制备方案中产生的气体B,既造成原料的浪费,也污染了环境。请你设计方案解决上述问题___________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】向用盐酸酸化的MgCl2、FeCl3混合溶液中逐滴滴入NaOH溶液,生成的沉淀质量与滴入NaOH溶液体积关系如图,则原混合溶液中MgCl2与FeCl3的物质的量之比为

A. ![]() B.
B. ![]() C.
C. ![]() D.
D. ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】降低发动机中柴油燃烧产生NOx的排放,可利用尿素分解产生的气体采用选择性催化还原技术或储存还原技术来消除污染。
(1)选择性催化还原技术工作原理为:

①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式_________。
②用2Kg尿素能处理标准状况下含NOx(以NO2计)体积分数为7%的尾气10m3,则该尿素的利用率为_____________。
③将上述尾气处理原理设计成原电池,在处理了废气的同时产生电能,其工作原理如图所示。则通入NH3的一极为_______________极,通入NOx时发生的电极反应方程式为___________。
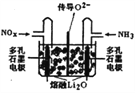
(2)储存还原技术工作原理为:NOx的储存和还原在不同时段交替进行,如图所示。
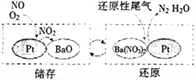
①写出上图中储存NO时发生的反应总方程式________________________。
②还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是(15N2N)2O3。将该反应的化学方程式补充完整:________![]() 口(15N2N)2O3+口H2O
口(15N2N)2O3+口H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】NaClO2的漂白能力是漂白粉的45倍。NaClO2广泛用于造纸工业、污水处理等。工业上生产NaClO2的工艺流程如下:

(1)ClO2发生器中的反应为2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4。实际工业生产中可用硫黄、浓硫酸代替反应原料中的SO2,其原因是_________________(用化学方程式表示)。
(2)反应结束后,向ClO2发生器中通入一定量空气的目的是_________________。
(3)吸收器中生成NaClO2反应的离子方程式为_________________,吸收器中的反应温度不能过高,可能的原因为_________________。
(4)某化学兴趣小组用如下图所示装置制备SO2并探究SO2与Na2O2的反应。

①为除去过量的SO2,C中盛放的试剂为___________。
②D中收集到的气体可使带余烬的木条复燃,B中硬质玻璃管内肯定发生反应的化学方程式为_________________。
③有同学认为B中硬质玻璃管内可能还有Na2SO4生成。为检验是否有Na2SO4生成,他们设计了如下方案:

同学们经过讨论,认为上述方案不合理,其理由是:a.____________;b.____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com