
科目: 来源: 题型:
【题目】钒和镍及其化合物是重要的合金材料和催化剂,其储氢合金可作为一种新型锌离子电池的负极材料,该电池以Zn(CF3SO3)2为电解质,以有缺陷的阳离子型ZnMn2O4为电极,成功获得了稳定的大功率电流。
(1)基态钒原子的价电子排布式为_______,其排布时能量最高的电子所占据能级的原子轨道有_______个伸展方向。
(2)VO2+与 可形成配合物。
可形成配合物。 中,三种非金属元素的电负性由大到小的顺序为_______ (用元素符号表示)。
中,三种非金属元素的电负性由大到小的顺序为_______ (用元素符号表示)。
(3)镍形成的配离子[Ni(NH3)6]2+、[Ni(CN)4]2-中,NH3分子的空间构型为_______。与CN-互为等电子体的一种分子的化学式为________ 。
(4)三氟甲磺酸(CF3SO3H)是一种有机强酸,结构式如图1所示,通常以CS2、IF5、H2O2等为主要原料来制取。
①H2O2分子中O原子的杂化方式为_______。
②三氟甲磺酸能与碘苯反应生成三氟甲磺酸苯酯和碘化氢。1个三氟甲磺酸苯酯分子中含有σ键的数目为_______。
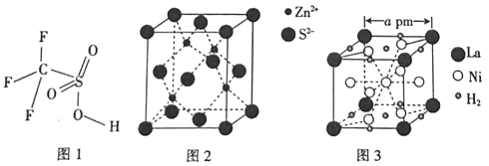
(5)硫化锌晶体的构型有多种,其中一种硫化锌的晶胞如图2所示,该晶胞中S2-的配位数为_________。
(6)镧镍合金是重要的储氢材料,其储氢后的晶胞如图3所示。
①储氢前该镧镍合金的化学式为_________。
②该镧镍合金储氢后氢的密度为_________(用NA表示阿伏加德罗常数的数值)g/cm3。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组为了探究常温下某非金属氧化物形成的未知气体的成分。该小组成员将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
【提出猜想】
猜想1:气体为CO2; 猜想2:气体为SO2; 猜想3:气体为CO2和SO2的混合气体。
为了验证猜想,该小组设计实验加以探究:
【实验探究】该小组同学按如图所示装置,将气体从a端通入,则:

(1)B中可以装下列________试剂(填编号)。
A、NaCl溶液 B、KMnO4溶液C、澄清石灰水
(2)A中品红溶液的作用是:_________________________________。
(3)C中品红溶液的作用是:_________________________________。
通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色③D中澄清石灰水变浑浊
【得出结论】
(4)由上述现象该小组同学确认该气体的成分为:______________________。
(5)请写出SO2与氯水发生反应的离子方程式:_________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】物质A、B、C、D、E、F、G、H、I、J、K有下图转化关系,D、E为气体单质,其中D为最轻的气体。试回答:
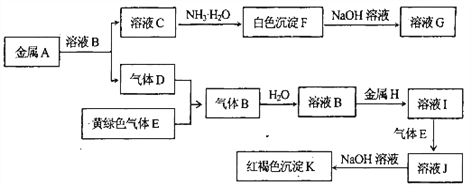
(1)写出物质K的化学式 _______________;
(2)写出A与NaOH溶液反应的化学方程式:______________________________________;
(3)写出反应“I→J”的离子方程式:____________________________________________;
(4)在溶液I中滴入NaOH溶液,可观察到的现象是:_______________________________;
(5)向1 L 0.2mol/L的C溶液中加入a ml 5mol/L的NaOH溶液得到了7.8g沉淀,求a=____mL。
查看答案和解析>>
科目: 来源: 题型:
【题目】CuCl晶体微溶于水和稀硫酸,不溶于乙醇,但易溶于浓盐酸和氯化铵溶液,发生的反应为:CuCl+Cl-![]() CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
(1)实验室保存新制CuCl晶体的方法是__________。
(2)向硫酸铜溶液中加入亚硫酸铵和氯化铵,会发生反应生成CuCl。
①该反应的离子方程式为_____________。
②(NH4)2SO3要适当过量,目的为保证Cu2+的还原速率、_____________。
③已知Cu2+的沉淀率与NH4Cl、CuSO4的物质的量之比[n(NH4Cl)/n(CuSO4)]的关系如图甲所示,当氯化铵用量增加到一定程度后,Cu2+的沉淀率减小,原因是_______________。

(3)已知:CuCl固体、CuOH固体分别为白色和橙黄色,且Ksp(CuCl)=1.2×10-6,Ksp(CuOH)=1.2×10-14。用铜电极电解饱和食盐水的装置如图乙所示,阳极的电极反应式为Cu-e-+Cl-=CuCl。则实验过程中的实验现象为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列水溶液一定呈中性的是( )
A.c(NH4+)=c(Cl﹣)的NH4Cl和氨水的混合溶液
B.c(H+)=1.0×10﹣7molL﹣1的溶液
C.pH=7的溶液
D.室温下将pH=3的酸与pH=11的碱等体积混合后的溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】已知反应:①Cl2+2KBr=2KCl+Br2, ②KClO3+6HCl=3Cl2+KCl +3H2O,
③2KBrO3+Cl2=Br2+ 2KClO3,下列说法正确的是
A. 上述三个反应都有单质生成,所以都是置换反应
B. 氧化性由强到弱顺序为 KBrO3>KClO3>Cl2>Br2
C. 反应②中还原剂与氧化剂的物质的量之比为6:1
D. ③中lmol还原剂反应则氧化剂得到电子的物质的量为2mol
查看答案和解析>>
科目: 来源: 题型:
【题目】I、化学上常见的混合物分离或提纯的基本装置如下:

(1)写出仪器名称:a______,b______________。
(2)从海带提取碘的操作如下,除特殊说明外,请在空白处填上上图相应装置中的序号:将干海带进行灼烧,海带灰中含有较多KI,将海带灰溶于水,然后______得到澄清滤液;向滤液中加入硫酸和H2O2混合溶液,得到棕褐色含有单质碘的水溶液。该反应的离子方程式为:______________。向碘的水溶液中加入适量CCl4,进行______操作将上下两层溶液分开。将含有碘的CCl4溶液置于蒸馏烧瓶内进行_____操作,可以粗略从CCl4溶液中分离出碘。
Ⅱ、某同学需用480mL0.5mol/LNa2CO3溶液,在实验室进行配制。
(1)该同学用托盘天平应称量______gNa2CO3粉末,使用容量瓶前必须进行的一步操作是_____。
(2)下图是该同学配制过程的一些关键步骤和操作图。

配制过程的先后顺序为(用字母A--F填写)_______。
(3)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将_____(填“偏高”、“偏低”、“不变”);步骤F如果俯视刻度线,配得溶液的浓度将______(填“偏高”、“偏低”、“不变”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com