
科目: 来源: 题型:
【题目】0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比( )
A. 5:2 B. 15:2 C. 3:1 D. 1:3
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液、胶体和浊液这三种分散系的根本区别是( )
A. 是否是大量分子或离子的集合体
B. 是否能通过滤纸
C. 分散质粒子直径的大小
D. 是否均一、透明、稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法或有关化学用语的表达不正确的是( )
A.在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量
B.核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量
C.某元素基态原子的电子排布图 ![]()
D.Ca2+离子基态电子排布式为1s22s22p63s23p6
查看答案和解析>>
科目: 来源: 题型:
【题目】元素在周期表中的位置,反映了元素的原子结构和元素的性质。如图是元素周期表的一部分。
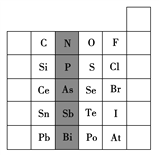
(1)阴影部分元素N在元素周期表中的位置为____周期第____族。根据元素周期律,预测酸性强弱:H3AsO4____H3PO4(填“>”或“<”)。
(2)S的最高化合价和最低化合价的代数和为____,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的程度比S与H2反应程度____(填“更大”“更小”或“相同”)。
(3)Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是____。
(4)下列说法错误的是____(填序号)。
①C、N、O、F的原子半径随着原子序数的增大而减小
②Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
③干冰升华、液态水转变为气态水都要克服分子内的共价键
④HF、HCl、HBr、HI的热稳定性依次减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中滴加酚酞 | ______________ |
ii. 连好装置一段时间后,向烧杯中滴加 | 铁片表面产生蓝色沉淀 |
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验i中的现象是_________。
②用化学用语解释实验i中的现象:__________。
(2)查阅资料: ![]() 具有氧化性。
具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是_________。
②进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 试管 | 现象 |
|
| iii. 蒸馏水 | 无明显变化 |
iv. 1.0 | 铁片表面产生大量蓝色沉淀 | ||
v. | 无明显变化 |
a. 以上实验表明:在__________条件下, 溶液可以与铁片发生反应。
b. 为探究![]() 的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后
的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后
再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明![]() 的作用是_________。
的作用是_________。
(3)有同学认为上述实验仍不严谨。为进一步探究![]() 的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是________(填字母序号)。
的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是________(填字母序号)。
实验 | 试剂 | 现象 |
A | 酸洗后的铁片、 | 产生蓝色沉淀 |
B | 酸洗后的铁片、 | 产生蓝色沉淀 |
C | 铁片、 | 产生蓝色沉淀 |
D | 铁片、 | 产生蓝色沉淀 |
(4)综合以上实验分析,利用实验ii中试剂,设计能证实铁发生了电化学腐蚀的实验方案__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(![]() )是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产
)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产![]() 的主要流程如下:
的主要流程如下:
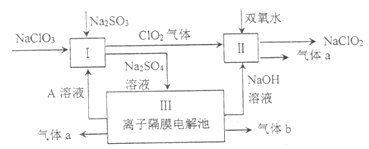
(1)I中发生反应的还原剂是________(填化学式)。
(2)II中反应的离子方程式是_________。
(3)III中离子隔膜电解池的装置如下:
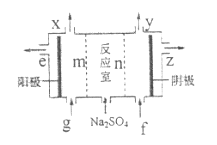
①A的化学式是_________,A在_________口产生。
②m为_______(填“阴”、“阳”)离子交换膜。
③结合化学用语和文字说明解释![]() 产生的原因:_________。
产生的原因:_________。
(4)![]() 是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备:
是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备: ![]()
①该反应中氧化剂和还原剂的物质的量之比是_________。
②研究表明:若反应开始时盐酸浓度越大,则气体产物中![]() 的含量越大,运用氧化还原反应规律分析其原因是___________。
的含量越大,运用氧化还原反应规律分析其原因是___________。
(5)![]() 变质可分解为
变质可分解为![]() 和
和![]() 。取等质量变质前后的
。取等质量变质前后的![]() 试样均配成溶液,分别与足量
试样均配成溶液,分别与足量![]() 溶液反应时,消耗
溶液反应时,消耗![]() 的物质的量前者_______(填>、<、=)后者。
的物质的量前者_______(填>、<、=)后者。
查看答案和解析>>
科目: 来源: 题型:
【题目】SCR和NSR技术可有效降低柴油发动机在空气过量条件下的![]() 排放。
排放。
(1)SCR(选择性催化还原)工作原理:

①尿素![]() 水溶液热分解为
水溶液热分解为![]() 和
和![]() ,该反应的化学方程式为_______。
,该反应的化学方程式为_______。
②反应器中![]() 还原
还原![]() 的化学方程式为_________。
的化学方程式为_________。
③当燃油中含硫量较高时,尾气中![]() 在
在![]() 作用下会形成
作用下会形成![]() ,使催化剂中毒。用化学方程式表示
,使催化剂中毒。用化学方程式表示![]() 的形成:_________。
的形成:_________。
④尿素溶液浓度影响![]() 的转化,测定溶液中尿素(
的转化,测定溶液中尿素(![]() )含量的方法如下:取ag尿素溶液,将所含氮完全转化为
)含量的方法如下:取ag尿素溶液,将所含氮完全转化为![]() ,所得
,所得![]() 用过量的
用过量的![]() mL
mL![]()
![]()
![]() 溶液吸收完全,剩余
溶液吸收完全,剩余![]() 用
用![]() 溶液恰好中和,则尿素溶液中溶质的质量分数是__________。
溶液恰好中和,则尿素溶液中溶质的质量分数是__________。
(2)(NSR ![]() 储存还原)工作原理:
储存还原)工作原理:
![]() 的储存和还原在不同时段交替进行,如图a所示。
的储存和还原在不同时段交替进行,如图a所示。

①通过BaO和![]() 的相互转化实现
的相互转化实现![]() 的储存和还原。储存
的储存和还原。储存![]() 的物质是________。
的物质是________。
②用![]() 模拟尾气中还原性气体研究了
模拟尾气中还原性气体研究了![]() 的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的
的催化还原过程,该过程分两步进行,图b表示该过程相关物质浓度随时间的变化关系。第一步反应消耗的![]() 与
与![]() 的物质的量之比是________。
的物质的量之比是________。
③还原过程中,有时会产生笑气(![]() )。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下
)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下![]() 与
与![]() 以一定比例反应时,得到的笑气几乎都是
以一定比例反应时,得到的笑气几乎都是![]() 。写出该反应的化学方程式__________。
。写出该反应的化学方程式__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在两份相同的![]() 溶液中,分别滴入物质的量浓度相等的
溶液中,分别滴入物质的量浓度相等的![]() 、
、![]() 溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是
溶液,其导电能力随滴入溶液体积变化的曲线如图所示。下列分析不正确的是
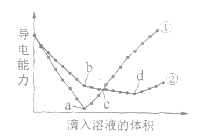
A. ①代表滴加![]() 溶液的变化曲线
溶液的变化曲线
B. b点,溶液中大量存在的离子是![]() 、
、![]()
C. a、d两点对应的溶液均显中性
D. c点,两溶液中含有相同量的![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】用价层电子对互斥理论预测H2S和BF3的立体结构,两个结论都正确的是( )
A.直线形;三角锥形
B.V形;三角锥形
C.直线形;平面三角形
D.V形;平面三角形
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中只含有K+, Fe3+, Cl-,SO42-四种离子,已知K+, Fe3+, Cl-的个数比为3:2:1。则溶液中Fe3+与SO42-离子的个数比为( )
A.1:2 B.1:4 C.3:4 D.3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com