
科目: 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是( )
A. Ⅰ中气体由无色变红棕色的化学方程式:2NO+O2═2NO2
B. Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对此Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目: 来源: 题型:
【题目】某探究性实验小组的同学将打磨过的镁条投入到滴有酚酞的饱和NaHCO3溶液中,发见反应迅速,产生大量气泡和白色不溶物,溶液的浅红色加深。该小组同学对白色不溶物的成分进行了探究和确定。
Ⅰ、提出假设:
(1)甲同学:可能是MgCO3;
乙同学:可能只是_____;
丙同学:可能是xMgCO3·yMg(OH)2
(2)探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,洗涤的方法是_________。
Ⅱ、定性实验探究:
(3)取沉淀物少许于试管中,加入稀盐酸固体溶解,产生大量气泡,则___同学假设错误(选填“甲乙或丙”)。
Ⅲ、定量实验探究:取一定量已干燥过的沉淀样品,利用下列装置测定其组成(部分固体夹持类装置未画出),经实验前后对比各装置的质量变化来分析沉淀的组成,得出丙同学的假设是正确的。请回答下列问题:

(4)实验合理的连接顺序: → → → → → →g→h(各装置只使用一次)。 _____________
(5)实验一段时间后,当B装置中_______(填实验现象),停止加热;再次打开f处的活塞,缓缓通入空气数分钟的目的是______,装置C中碱石灰的作用是______。
(6)指导老师认为上述实验装置中末端还需再链接一个D装置,若无此装置,会使测出的x :y的值 ______(填偏大偏小无影响).
(7)若改进实验后,最终装置B质量增加m克,装置D质量增加了n克,则x :y=___________。(用含m、n的代数式表示)
查看答案和解析>>
科目: 来源: 题型:
【题目】20世纪80年代中期,科学家发现并证明碳还以新的单质形态C60存在.后来人们又相继得到了C70、C76、C84、C90、C94等另外一些球碳分子.90年代初,科学家又发现了管状碳分子和洋葱状碳分子.(如图):下列说法错误的是( ) 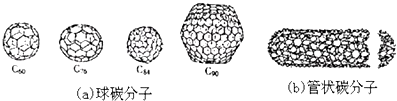
A.金刚石和石墨的熔点肯定要比C60高
B.据估计C60熔点比金刚石和石墨要高
C.无论是球碳分子,还是管状碳分子、洋葱状碳分子,都应看作是碳的同素异形体
D.C60的熔点低于C90
查看答案和解析>>
科目: 来源: 题型:
【题目】功能高分子P可用作光电材料,其合成路线如下:

已知:
i: ![]() (R,R’表示氢或烃基)
(R,R’表示氢或烃基)
ii. 
iii. 
(1)烃A的相对分子质量是26,其结构简式是_________。
(2)反应①的反应类型是__________。
(3)C中含有的官能团名称是___________。
(4)D为苯的同系物,反应③的化学方程式是_________。
(5)G的结构简式是__________。
(6)反应⑨的化学方程式是__________。
(7)反应⑤和⑦的目的是___________。
(8)以乙炔和甲醛为起始原料,选用必要的无机试剂合成1,3-丁二烯,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)。___________
查看答案和解析>>
科目: 来源: 题型:
【题目】有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。

回答下列问题:
(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为 ,C的元素名称为 ,
D的单质与水反应的方程式为_ 。
(3)向D与E形成的化合物的水溶液中滴入烧碱溶液直至过量,观察到的现象是 ,有关反应的离子方程式为 ; 。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液中的氯离子浓度与50 mL 1 mol·L-1的氯化铝溶液中的氯离子浓度相等的是( )
A. 150 mL 1 mol·L-1的NaCl B. 150 mL 1 mol·L-1的KCl
C. 75 mL 3 mol·L-1的NH4Cl D. 75 mL 2 mol·L-1的CaCl2
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组在实验室模拟用软锰矿(主要成分![]() ,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
,杂质为铁及铜的化合物等)制备高纯碳酸锰,过程如下(部分操作和条件略):
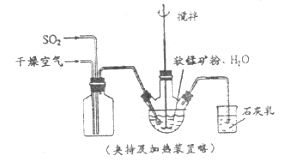
①缓慢向烧瓶中(见上图)通入过量混合气进行“浸锰”操作,主要反应原理为: ![]()
![]() (铁浸出后,过量的
(铁浸出后,过量的![]() 会将
会将![]() 还原为
还原为![]() )
)
②向“浸锰”结束后的烧瓶中加入一定量纯![]() 粉末。
粉末。
③再用![]() 溶液调节pH为3.5左右,过滤。
溶液调节pH为3.5左右,过滤。
④调节滤液pH为6.5-7.2,加入![]() ,有浅红色沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
,有浅红色沉淀生成,过滤、洗涤、干燥,得到高纯碳酸锰。
(1)“浸锰”反应中往往有副产物![]() 的生成,温度对“浸锰”反应的影响如下图,为减少
的生成,温度对“浸锰”反应的影响如下图,为减少![]() 的生成,“浸锰”的适宜温度是___________。
的生成,“浸锰”的适宜温度是___________。
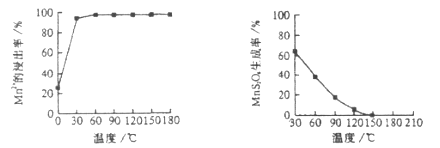
图1 温度对锰浸出率的影响 图2 浸锰温度与![]() 生成率的关系
生成率的关系
(2)查阅表1,③中调pH为3.5时沉淀的主要成分是________。②中加入一定量纯![]() 粉末的主要作用是_________,相应反应的离子方程式为_______。
粉末的主要作用是_________,相应反应的离子方程式为_______。
表1:生成相应氢氧化物的pH
物质 |
|
|
|
|
| 开始沉淀pH | 2.7 | 7.6 | 8.3 | 4.7 |
完全沉淀pH | 3.7 | 9.6 | 9.8 | 6.7 |
(3)③中所得的滤液中含有![]() ,可添加过量的难溶电解质MnS除去
,可添加过量的难溶电解质MnS除去![]() ,经过滤,得到纯净的
,经过滤,得到纯净的![]() 。用平衡移动原理解释加入MnS的作用__________。
。用平衡移动原理解释加入MnS的作用__________。
(4)④中加入![]() 后发生反应的离子方程式是__________。
后发生反应的离子方程式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com