
科目: 来源: 题型:
【题目】某研究性学习小组得到一块软锰矿样品,其主要成分为二氧化锰(MnO2)和石英(SiO2)。为了制取氯气并进行氯气的性质实验,其装置如图所示,请回答下列问题:
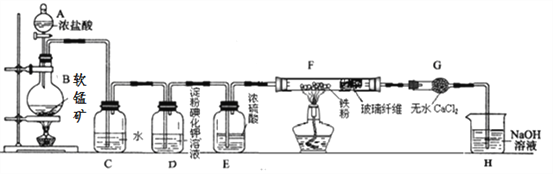
(1)取适量软锰矿置于烧瓶中,加入足量浓盐酸并加热,烧瓶中发生的化学反应为:MnO2 +4HCl(浓)![]() MnCl2+Cl2↑+2H2O。充分反应后烧瓶中残留的固体是____________;若有4mol浓盐酸参与反应,产生的氯气在标准状况下的体积为____22.4L (填“等于”、“小于”或“大于”),浓盐酸在该反应中表现出来的性质_______________________;
MnCl2+Cl2↑+2H2O。充分反应后烧瓶中残留的固体是____________;若有4mol浓盐酸参与反应,产生的氯气在标准状况下的体积为____22.4L (填“等于”、“小于”或“大于”),浓盐酸在该反应中表现出来的性质_______________________;
(2)若将干燥的有色布条放入C中,观察到的现象是 ______ ,原因是 ______________ (用化学方程式和文字回答);
(3)实验中观察到D溶液变蓝色,写出D装置中发生反应的离子方程式 ____________ ;
(4)为探究氯气与Fe反应的产物与氯气通入量的关系,设计实验,并记录现象如下:
实验方法 | 实验现象 | 实验结论 |
1.取反应初始阶段(氯气不足量)F中产物,用磁铁除去过量的Fe,剩余产物溶于水中,取上层溶液装入两只试管中,①加入KSCN溶液,②加入KMnO4溶液 | ①KSCN溶液显红色 ②KMnO4溶液不褪色 | (不填) |
2.取充分反应后(氯气通入足够长时间)F中产物,溶于水中,加入KMnO4溶液 | KMnO4溶液不褪色 |
根据实验现象,得出实验结论,写出氯气与Fe粉共热时发生反应的化学方程式______;
(5)已知F中的产物易潮解,在F和H装置之间安装G装置,目的是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述中正确的是( )
A. 纯碱从物质的分类看不属于碱 B. 由一种元素组成的物质一定是单质
C. 单质只能用置换反应制取 D. 含氧元素的化合物称为氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.某混合物的无色溶液中,可能含有以下离子中的若干种:K+、Ca2+、Fe3+、NH4+、Cl-、CO32-和SO42-。现每次取10.00mL进行实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH后加热,收集到气体448mL(标准状况下);
③第三份加入足量BaCl2溶液后,生成白色沉淀,过滤、干燥,得到固体4.30g,该固体经足量盐酸洗涤,干燥后剩余2.33g。
(1)c(CO32-)=______mol·L1;
(2)某同学认为该溶液中一定存在K+,浓度范围是_________________;
(3)根据以上实验,某离子可能存在。检验该离子是否存在的方法是___________________________;
(4)写出③中固体加入足量盐酸洗涤的离子方程式________________________________。
Ⅱ.四种物质有如下相互转化关系:

(5)若化合物A是红棕色粉末状固体,化合物B是一种既可以与强酸溶液反应又可以与强碱溶液反应的氧化物,则该反应的化学方程式为____________________;
(6)若甲是活泼金属,化合物B是强碱,则该反应的离子方程式为____________;
(7)若乙是黑色固体,化合物B是优质的耐高温材料。则该反应的化学方程式为____________________;
(8)若化合物A可作光导纤维材料,乙是一种重要的半导体材料。则该反应的化学方程式为____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国有丰富的海水资源,开发和利用海水资源是当前科学研究的一项重要任务,如图是海水综合利用的一个方面。

Ⅰ.(1)上述过程中没有涉及到的四大基本反应类型是 ______;
a.化合反应 b.分解反应 c.置换反应 d.复分解反应
(2)步骤1中分离操作的名称是___________;
(3)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制时所用试剂为:
a.盐酸 b.BaCl2溶液 c.NaOH溶液 d.Na2CO3溶液
加入试剂的顺序是_____________;
II.实验室利用精盐配制480mL 2.0mol·L1NaCl溶液。
(4)除容量瓶外,还需要的玻璃仪器有___________________;
(5)用托盘天平称取固体NaCl________g;
(6)配制时,按以下几个步骤进行:①计算 ②称量 ③溶解 ④冷却 ⑤转移 ⑥定容 ⑦摇匀 ⑧装瓶。操作中还缺少一个重要步骤是______________________;
(7)下列错误操作可使所配制氯化钠溶液浓度偏低的是(_________)
a.容量瓶洗净后残留了部分的水
b.转移时溶液溅到容量瓶外面
c.定容时俯视容量瓶的刻度线
d.摇匀后见液面下降,再加水至刻度线
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯氧化铁性能稳定,无毒、无臭、无味,是食品、药品、化妆品常用着色剂。 某实验小组用工业FeCl3粗品(含Ca、Mn、Cu等杂质离子)为原料,以萃取剂Y(甲基异丁基甲酮)萃取法制取高纯氧化铁。实验过程中的主要操作步骤如下:
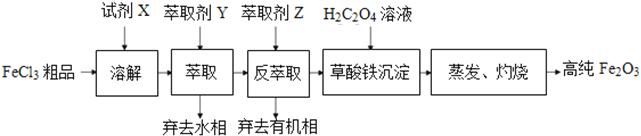
已知:试剂X是浓盐酸,HCl(浓)+FeCl3![]() HFeCl4
HFeCl4
请回答下列问题:
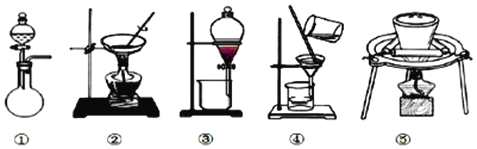
(1)据上述实验操作过程判断,下列实验装置中,没有用到的是_________(填序号)
(2)用萃取剂Y萃取的步骤中:
①Ca、Mn、Cu等杂质离子几乎都在_________ (填“水”或“有机”)相中。
②分液时,为保证液体顺利流下,应先_________,再打开旋塞,待下层液体完全流尽时,关闭悬塞后再从上口倒出上层液体。
(3)制备萃取剂Y(甲基异丁基甲酮)时,其粗产品中含有异丙叉丙酮、4-甲基-2-戊醇、酸性物质等杂质。一般可采用蒸馏法进行提纯。蒸馏时,应将温度计水银球置于_________。蒸馏前,预处理粗产品时,可以先用_________洗(填所选试剂对应的字母,下同),后用_________洗,最后用_________洗。
A水 B碳酸氢钠溶液 C乙醇
(4)下列试剂中,反萃取剂Z的最佳选择是_________,反萃取能发生的原因是_________(从化学平衡的角度进行解释)。
A.高纯水 B.盐酸 C.稀硫酸 D.酒精
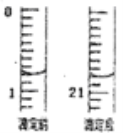
(5)测定产品中氧化铁的含量需经酸溶、还原为Fe2+,然后在酸性条件下用标 准K2Cr2O7溶液滴定(还原产物是Cr3+,杂质不与K2Cr2O7反应)。现准确称取1.0g样品经酸溶、还原为Fe2+,用0.1000mol/L的标准溶液进行滴定。
①滴定起始和终点的液面位置如图,则消耗K2Cr2O7标准溶液体积为_________mL。
②产品中氧化铁的含量为_________(保留三位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E是元素周期表中前四周期中五种常见元素,其相关信息如表:
元素 | 相关信息 |
A | 原子核外L层电子数是K层的2倍 |
B | 其一种单质被称为地球生物的“保护伞” |
C | 元素的第一电离能是第3周期所有元素中最小的 |
D | 基态原子最外层电子排布为(n+1)sn(n+1)p(n+2) |
E | 可形成多种氧化物,其中一种为具有磁性的黑色晶体 |
请回答下列问题:
(1)C在元素周期表中位于第周期、第族;D的基态原子核外电子排布式是 .
(2)B、C、D的简单离子半径由大到小的顺序为(用化学符号表示,下同) , B、D的简单氢化物中稳定性较大的是 .
(3)B的常见单质和C的单质按物质的量比1:2反应生成的化合物中化学键的类型为;该化合物属于晶体.
(4)E形成的黑色磁性晶体发生铝热反应的化学方程式是 .
(5)已知:2AB(g)+B2(g)═2AB2(g)△H=﹣566.0kJmol﹣1
D(s)+B2(g)═DB2(g)△H=﹣296.0kJmol﹣1
处理含AB、DB2烟道气污染的一种方法是将其在催化剂作用下转化为固态单质D,请写出此反应的热化学方程式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. 氯化钠溶液在电流作用下电离成Na+与Cl
B. 溶于水后能电离出H+的化合物都是酸
C. 氯化氢水溶液能导电,所以氯化氢是电解质
D. O2的水溶液能不导电,所以O2是非电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:

则x=______________________。
(2)甲醇作为一种重要的化工原料,既可以作为燃料,还可用于合成其它化工原料。在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为:CH3OH(g) +CO(g) ![]() HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:
HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,改变的反应条件是____________________。
②反应Ⅰ在5min时达到平衡,在此条件下从反应开始到达到平衡时速率v(HCOOCH3)=__________。
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ) =__________。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1mol CO和2mol HCOOCH3后v(正)_____v(逆)(填“﹥”“﹤”“﹦”),原因是_________________。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1______T3(填“﹥”“﹤”“﹦”),判断的理由是________________。
(3)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应填空:
2NO+2CO![]() N2+ 2CO2(有CO) 2NO
N2+ 2CO2(有CO) 2NO![]() N2+ O2(无CO)
N2+ O2(无CO)

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为____________________。
②在n(NO)/n(CO)=1的条件下,应控制的最佳温度在___左右.
A.670K B.770K C.870K D.970K.
查看答案和解析>>
科目: 来源: 题型:
【题目】电化学是研究电能与化学能相互转化的科学.请回答:
(1)原电池是将能转化为能的装置,一般较活泼的金属做
极,发生反应.电子流向极(填“正”或“负”).
(2)分析图,写出有关的电极反应式:
锌棒上的电极反应式为
碳棒上的电极反应式为 . 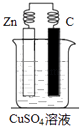
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com