
科目: 来源: 题型:
【题目】根据所学知识填空。
(1)根据无机含氧酸的酸性规律,将下列四种无机含氧酸按酸性相近两两组成一组,它们是和;和 . (用序号表示)
①H3PO4 ②HClO ③H3BO3 ④HNO2
(2)甲烷晶体的晶胞结构与干冰类似,则与一个甲烷分子紧密相邻的甲烷分子有个.
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好.离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 .
(4)SiC晶体与金刚石的结构相似,其中C原子和Si原子的位置是交替的,在SiC中最小的环上有个原子,SiC与金刚石相比,熔点较高,
原因是 .
(5)铁晶体的晶胞结构如图,铁原子的空间利用率为 , 已知:铁的密度是dg/cm3 , 阿伏加德罗常数为NA , 则铁原子的半径是cm. 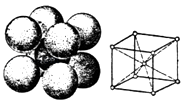
查看答案和解析>>
科目: 来源: 题型:
【题目】如表为长式周期表的一部分,其中的编号代表对应的元素. 
请回答下列问题:
(1)科学家发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为(用对应的元素符号表示).
(2)某元素的价电子排布式为nsnnpn+1 , 该元素与元素①形成的18电子的X分子的结构式为;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为 .
(3)比较③,⑤,⑥,⑦,⑧五种元素的电负性大小,由大到小排列的顺序为(用 元素符号表示).
(4)⑩元素单质晶体采取堆积方式 , 空间利用率为 . 
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的金属Na、Mg、Al分别与100mL 2molL-1的盐酸反应,实验测得生成气体的体积V(已折合为标准状况)与时间t的关系如图所示,则下列说法不正确的是( )
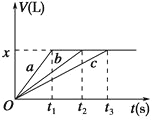
A. x=2.24
B. 三种金属的物质的量均为0.2 mol
C. 反应时,Na、Mg、Al均过量
D. 曲线b为Mg与盐酸反应的图象
查看答案和解析>>
科目: 来源: 题型:
【题目】每年10月23日上午6:02到晚上6:02被脊为“摩尔日"(Mole Day),这个时间的美式写法为6:0210/23,外观与阿伏加德罗常数6.02×1023相似。NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下22.4 LNO与11.2LO2 充分反应,产物的分子数为NA
B. 0.1mol/L的Na2SO4溶液中,SO42- 数目是0.1NA
C. 标准状况下.22.4L氯气与足量铁粉充分反应,转移的电子数为3NA
D. 0.1molCH4的核外电子数为NA
查看答案和解析>>
科目: 来源: 题型:
【题目】右图是学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是

A.该硫酸试剂的物质的量浓度为18.4 mol/L
B.稀释该硫酸时应把水倒入硫酸中,边倒边搅拌
C.50 mL该H2SO4中加入足量的铜片并加热,被还原的H2SO4的物质的量为0.46 mol
D.标准状况下2.7 g Al与足量的该硫酸反应可得到H2 3.36 L
查看答案和解析>>
科目: 来源: 题型:
【题目】德国化学家哈伯从1902 年开始研究由氮气和氢气直接合成氨,反应原理为:N2(g)+3H2(g)![]() 2NH3(g) △H=-92.4kJmol-1
2NH3(g) △H=-92.4kJmol-1
(1)在恒温恒容条件下,向反应平衡体系中充入氮气,达到新平衡时,c(H2)将_________(填“增大”、“减小”、“不变”或“无法判断”,下同),c(N2)·c3(H2)将___________。
(2)工业上可用CH4与水蒸气制氢气:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
CO(g)+3H2(g)。在200℃时2L的密闭容器中,将1molCH4和1mol H2O(g)混合,达平衡时CH4 的转化率为80%。则200℃时该反应的平衡常数K=______________(保留一位小数)。
(3)如图为合成氨反应在不同温度和压强、使用相同催化剂条件下,初始时氮气、氢气的体积比为1:3 时,平衡混合物中氨的体积分数。若分别用vA(NH3)和vB(NH3)表示从反应开始至达平衡状态A、B 时的化学反应速率,则vA(NH3)____ ( 填“>”“<”或“=”)vB(NH3)。

(4)工业生产中逸出的氨可用稀硫酸吸收。若恰好生成NH4HSO4,该溶液中各离子的物质的量浓度由大到小的顺序是______________________。
(5)H2NCOONH4是工业合成尿素的中间产物,该反应的能量变化如图所示,用CO2和氨合成尿素的热化学方程式为_________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据已学知识,请你回答下列问题:
(1)写出原子序数最小的第Ⅷ族元素原子的原子结构示意图 .
(2)写出3p轨道上有2个未成对电子的元素的符号: .
(3)该元素被科学家称之为人体微量元素中的“防癌之王”,其原子的外围电子排布式为4s24p4 , 该元素的名称是 .
(4)已知下列化学键的键能:Si﹣O:460kJ/mol,Si﹣Si:175kJ/mol,O=O:498kJ/mol,则反应:Si+O2=SiO2的反应热△H= .
(5)写出二氧化硫和水合氢离子中S原子,O原子分别采用和杂化形式,其空间构型分别为和 .
(6)用氢键表示法表示HF水溶液中的所有氢键、、、 .
查看答案和解析>>
科目: 来源: 题型:
【题目】将30mL 0.5mol/LNaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度为( )
A.0.3 mol/LB.0.03 mol/LC.0.05 mol/LD.0.04 mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. 在接触室里用98.3%的浓硫酸吸收SO3,目的是防止形成酸雾便于SO3吸收完全
B. 工业制玻璃和炼铁过程中都要加入石灰石,目的是除去杂质二氧化硅
C. 工业制备和提纯硅的三步化学反应都是氧化还原反应
D. 氯碱工业得到的产品可以用来制盐酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com