
科目: 来源: 题型:
【题目】美国科学家用某有机分子和球形笼状分子C60制成了“纳米车”(如图所示),每辆“纳米车”是由一个有机分子和4个C60分子构成。“纳米车”可以用来运输单个的有机分子。下列说法正确的是

A. 人们用肉眼可以清晰看到“纳米车”的运动
B. “纳米车”诞生说明人类操纵分子的技术进入了一个新阶段
C. C60是一种新型的化合物
D. C60与12C是同位素
查看答案和解析>>
科目: 来源: 题型:
【题目】由FeO、Fe3O4和Fe2O3组成的混合物,测得其中铁元素与氧元素的质量比为21:8,则该混合物中FeO、Fe3O4和Fe2O3的物质的量之比可能是
A. 1:2:1 B. 2:1:1 C. 1:2:2 D. 1:1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是
A. 沸点:H2O>HFB. 热稳定性:HF>H2O
C. NCl3、SiCl4分子中每个原子最外层均满足8电子结构D. 仅由N、H、O三种元素形成的化合物中不可能含离子键
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.煤、石油、天然气是当今世界最重要的三种化石燃料
B.CaO+H2O=Ca(OH)2可放出大量热,可利用该反应设计成原电池,把化学能转化为电能
C.决定化学反应速率的主要因素为反应温度
D.人体运动所消耗的能量与化学反应无关
查看答案和解析>>
科目: 来源: 题型:
【题目】用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备碱式碳酸铜的流程如下:
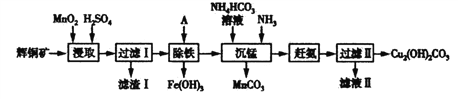
(1)辉铜矿中铜元素的价态为_________________。
(2)滤渣Ⅰ的成分除了不溶性矿渣外,还有S、__________、______________,写出“浸取”过程中生成S 的离子方程式_______________________。
(3)也可用FeCl3代替MnO2作浸取剂。若向FeCl3浸取液中加入CuCl2 ,能加快铜元素的浸取速率,该过程的反应原理可用化学方程式表示为:①Cu2S+2CuCl2=4CuCl+S;②____________。
(4)“沉锰”时发生的反应的离子方程式为____________________。
(5)滤液Ⅱ经结晶得到的盐主要是____________(填化学式,下同),流程中可循环的物质是_________________。
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见下图,转化时负极的电极 反应式为___________________。
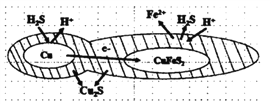
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.同一周期相邻主族的两种元素的原子序数之差一定是1
B.同一主族的两种元素的原子序数之差可能是36
C.同一主族相邻周期的两种元素的原子序数之差可能是26
D.同一主族相邻周期的两种元素的原子序数之差都相同
查看答案和解析>>
科目: 来源: 题型:
【题目】20℃时,饱和NaCl溶液密度为1.1g.cm-3,物质的量浓度为5.0mol·L-1,下列说法不正确的是
A. 25℃时,饱和NaCl溶波的物质的量浓度大于5.0mol/L
B. 20℃时,饱和NaCl溶液的质量分数约为26.6%
C. 20℃时,密度小于1.1g/cm3的NaCl溶液是不饱和溶液
D. 将此饱和NaCl溶液蒸发部分水,再恢复到20℃时,溶液密度一定大于1.1g/cm3
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·2H2O)是一种黄色难溶于水的固体,受热易分解,是生产锂电池、涂料、着色剂以及感光材料的原材料。
Ⅰ、草酸亚铁晶体的制备:

(1)步骤①硫酸亚铁铵晶体加稀硫酸溶解的原因是___________________。
(2)步骤2倾析的作用是使固液分离,具体操作是静置后,将沉淀上部的溶液倾入另一容器,从而获得固体。倾析法与普通的过滤相比,明显的优点是____________________。
(3)硫酸亚铁铵俗称莫尔盐,在空气中比一般的亚铁盐稳定,较难被氧化,其水溶液的性质与组成它的简单盐的混合溶液没有区别。设计简单实验证明硫酸亚铁铵比硫酸亚铁更稳定______________________。
Ⅱ、测定草酸亚铁的纯度:
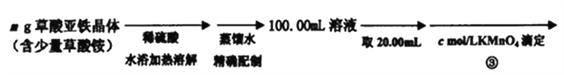
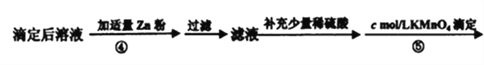
(4)在步骤③的溶液中除发生反应MnO4-+8H++5Fe2+=5Fe3++Mn2++4H2O 外,还有另一氧化还原反应,写出该反应的离子方程式__________________ ;用KmnO4标准溶液滴定至终点的现象是_____________________。
(5)步骤④加入适量锌粉的目的是________________。
(6)相同条件下,重复滴定三次,步骤③平均消耗KmnO4标准溶液V1mL,步骤⑤平均消耗V2mL,则mg固体样品的纯度计算式为______________。(用相关字母表示,不必化简)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com