
科目: 来源: 题型:
【题目】某研究小组为了探究一种无机矿物盐X(仅含四种元素)的组成和性质,设计并完成如下实验:
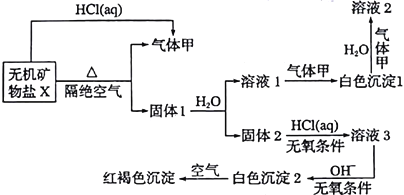
另取21.6gX在惰性气流中加热至完全分解,得到12.8g固体1和0.2mol气体甲。
(1)画出白色沉淀1中金属元素的原子结构示意图_____________,写出气体甲的电子式_______。
(2)X的化学式是______________,在惰性气流中加热X至完全分解的化学反应方程式为______________________________________。
(3)白色沉淀2在空气中变成红褐色沉淀的原因是_______(用化学反应方程式表示)。
(4)一定条件下,气体甲鱼固体1中的某种成分可能发生氧化还原反应,写出一个有气体生成的可能的化学反应方程式______________________________,并设计实验方案验证该反应的产物___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知难溶性物质K2SO4MgSO42CaSO4在水中存在如下平衡:K2SO4MgSO42CaSO4 (s)2Ca2++2K++Mg2++4SO42﹣ . 不同温度下,K+的浸出浓度与溶浸时间的关系如图所示,则下列说法错误的是( ) 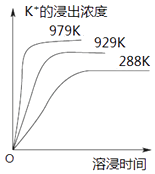
A.该平衡的Ksp=c2(Ca2+)c2(K+)c(Mg2+)c4(SO42﹣)
B.向该体系中加入饱和K2SO4溶液,溶解平衡向左移动
C.升高温度,溶浸速率增大,平衡向正反应方向移动
D.向该体系中加入饱和NaOH溶液,溶解平衡不发生移动
查看答案和解析>>
科目: 来源: 题型:
【题目】从樟科植物枝叶提取的精油中含有一种有机物 ![]() ,则对该有机物的说法正确的是( )
,则对该有机物的说法正确的是( )
A.能使溴水、酸性高锰酸钾溶液褪色
B.分子中所有原子在同一平面内
C.分子式为C9H12O
D.能发生加成反应、酯化反应、水解反应
查看答案和解析>>
科目: 来源: 题型:
【题目】已知有机化合物X中各元素的质量分数分别为C﹣﹣﹣60%,H﹣﹣﹣13.3%,O﹣﹣﹣26.7%. 请填空:
(1)有机物X的实验式为 . 若0.1molX在足量氧气中充分燃烧需消耗氧气10.08L(标准状况),则X的分子式为 .
(2)实验表明:X能与金属钠反应产生H2 . X分子的核磁共振氢谱中有4个吸收峰,且面积之比为3:2:2:1,则X分子中含有的官能团的名称为 , X的结构简式为 .
(3)X有两种同分异构体Y和Z,其中Y能与金属钠反应产生H2 , 而Z不能.则Y、Z的结构简式分别为、 .
查看答案和解析>>
科目: 来源: 题型:
【题目】高纯晶体硅是信息技术的关键材料。
(1)硅元素位于周期表的__________周期_________族。下面有关硅材料的说法中正确的是________(填字母)。
A.碳化硅化学性质稳定,可用于生产耐高温水泥
B.氮化硅硬度大、熔点高,可用于制作高温陶瓷和轴承
C.高纯度的二氧化硅可用于制造高性能通讯材料光导纤维
D.普通玻璃是由纯碱、石灰石和石英砂制成的,故在玻璃尖口点燃H2时出现黄色火焰
E. 盐酸可以与硅反应,故采用盐酸为抛光液抛光单晶硅
(2)工业上用石英砂和焦炭可制得粗硅。
已知:

请将以下反应的热化学方程式补充完整:SiO2(s)+2C(s)═Si(s)+2CO(g) △H=_____________
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解生成高纯硅.已知硅烷的分解温度远低于甲烷,用原子结构解释其原因:________________________________,Si元素的非金属性弱于C元素,硅烷的热稳定性弱于甲烷。
(4)将粗硅转化成三氯氢硅(SiHCl3),进一步反应也可制得高纯硅。
①SiHCl3中含有的SiCl4、AsCl3等杂质对晶体硅的质量有影响.根据下表数据,可用_________________方法提纯SiHCl3。
物质 | SiHCl3 | SiCl4 | AsCl3 |
沸点/℃ | 32.0 | 57.5 | 131.6 |
②用SiHCl3制备高纯硅的反应为SiHCl3(g)+H2(g) ![]() Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是_____________________(填字母序号)。
Si(s)+3HCl(g),不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是_____________________(填字母序号)。
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是![]()
C.实际生产中为提高SiHCl3的利用率,应适当升高温度
③整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HC1和另一种物质,写出配平的化学反应方程式:____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、磷、砷为同主族元素,回答下列问题:
(1)基态As原子的核外电子排布式为 .
(2)镓氮砷合金材料的太阳能电池效率达40%,这3种元素的电负性由大至小的顺序是(用元素符号表示)
(3)As4O6的分子结构如图1所示,其中As原子的杂化方式为 , 1mol As406含有σ键的物质的量为 . 
(4)该族氢化物RH3(NH3、PH3、AsH3)的某种性质随R的核电荷数的变化趋势如图2所示.则Y轴可表示的氢化物(RH3)性质可能是 . 
A.稳定性
B.沸点
C.R﹣H键能
D.分子间作用力
(5)AsH3的沸点(﹣62.5℃)比NH3的沸点(﹣33.5℃)低,原因是
(6)NH4+中的H﹣N﹣H的键角比 NH3中的H﹣N﹣H的键角(填”大”或”小”),原因是
查看答案和解析>>
科目: 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
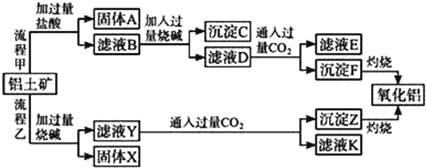
请回答下列问题:
(1)固体A的主要成分是______________(写名称).
(2)铝土矿与过量烧碱反应的离子方程式为______、______.
(3)电解熔融氧化铝可制得两种单质,写出该反应化学方程式______________.
(4)指出流程乙的一个缺点是____________.
(5)氧化铝与焦炭的混合物在氮气中高温加热反应,制得新型非金属材料AlN与一种中学常见气体X.已知每转移6.02×1023个电子,有0.5mol化合物X生成,此反应的化学方程式________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
(1)准确称取4.1g烧碱样品.将样品配成250mL待测液,需要的仪器除了小烧杯、玻璃棒、量筒还需要 .
(2)取10.00mL待测液,用量取.
(3)用0.2010molL﹣1标准盐酸滴定待测烧碱溶液,甲基橙做指示剂,滴定时左手旋转滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视的现象时即到达滴定终点.
(4)根据下列数据,计算待测烧碱溶液的纯度: . (保留四位有效数字)
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 0.10 | 22.10 |
第三次 | 10.00 | 4.00 | 24.10 |
(5)以下操作会造成测量结果偏高的是 ①用蒸馏水冲洗锥形瓶;
②在滴定过程中不慎将数滴酸液滴在锥形瓶外;
③读数时,滴定前仰视,滴定后俯视;
④装标准液之前,没有用标准液润洗滴定管.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com