
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值.下列说法正确的是( )
A.1L 0.1mol?L﹣1的NaHCO3溶液中HCO ![]() 和CO
和CO ![]() 离子数之和为0.1NA
离子数之和为0.1NA
B.50ml 12mol/L盐酸与足量MnO2共热,转移的电子数为0.3NA
C.过氧化钠与CO2反应时,生成0.1mol氧气转移的电子数为0.2NA
D.密闭容器中2molNO与1molO2充分反应,产物的分子数为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】苯乙烯是工业上是合成树脂、离子交换树脂及合成橡胶等的重要单体,工业上可用乙苯催化脱氢方法制备苯乙烯:![]() (g)
(g)![]() (g)+H2(g) △H=+QkJ·mol-1
(g)+H2(g) △H=+QkJ·mol-1
请回答下列问题:
(1)已知乙苯(g)、苯乙烯(g)的燃烧热分别为a kJ·mol-1、bkJ·mol-1,则氢气的燃烧热为_____kJ·mol-1(用含有Q、b、c的表达式表示,其中Q、b、c均大于0)。
(2)673 K时,在一恒容密闭容器中充入5 mol乙苯(g),反应达到平衡后容器内气体的压强为p1;若再充入amol的乙苯(g),重新达到平衡后容器内气体的压强为2p1,则a____________5。
(3)在实际生产中,在恒压条件下常以高温水蒸气作为反应体系的稀释剂(水蒸气不参加反应),此时乙苯的平衡转化率与水蒸气的用量、压强(p)的关系如图所示。
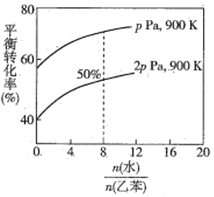
①加入水蒸气稀释剂能提高乙苯转化率的原因是________________________________。
②在实际生产过程中,当控制反应温度为900 K时生产效率最佳,选用此温度进行生产的原因为________ (答两点)。
③用平衡分压代替平衡浓度计算,其中,分压=总压×物质的量分数,则900K时的平衡常数Kp=_______。
④改变下列条件,能使乙苯的反应速率和转化率一定增大的是________ (填标号)。
A.恒容时加入稀释剂水蒸气 B.压强不变下,温度升至1500 K
C.在容积和温度不变下充入Ar D.选用催化效果更好的催化剂
(4)已知苯乙烯可催化氧化生成苯乙醛: ![]() (g) + 2O2→
(g) + 2O2→![]() + CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为___________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________ mol。
+ CO2 + H2O,若把该反应设计为酸性燃料电池,则电池负极的电极反应式为___________________,若该电池消耗标准状况下11.2 L的O2,则外电路中理论上应转移电子的物质的量为________ mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】据新浪网报道,欧洲一集团公司拟在太空建立巨大的集光装置,把太阳光变成激光用于分解海水制氢,其反应可表示为:2H2O ![]() 2H2↑+O2↑.有下列几种说法:①水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③使用氢气作燃料有助于控制温室效应;④氢气是一级能源.其中叙述正确的是( )
2H2↑+O2↑.有下列几种说法:①水分解反应是放热反应;②若用生成的氢气与空气中多余的二氧化碳反应生成甲醇储存起来,可改善生存条件;③使用氢气作燃料有助于控制温室效应;④氢气是一级能源.其中叙述正确的是( )
A.①②
B.③④
C.②③
D.①②③④
查看答案和解析>>
科目: 来源: 题型:
【题目】用锌片与1 mol·L-1稀盐酸反应制取氢气时,下列措施不能使氢气生成速率增大的是
A.对该反应体系加热
B.加入少量NaCl溶液
C.不用锌片,改用锌粉
D.加入少量1 mol·L-1硫酸
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定条件下,将A2和B2两种气体通入1 L密闭容器中,反应按下式进行:xA2+ yB2==2C(g), 两秒种后反应速率如下v(A2)=0.4mol/(L·s) v (B2)= 1.2 mol/(L·s) v(C)= 0.8mol/(L·s) 则该x和y的值分别为
A.2和3B.3和2C.3和1D.1和3
查看答案和解析>>
科目: 来源: 题型:
【题目】某固体样品由Na2CO3和NaHCO3两种试剂组成,现取27.4g该样品置于试管中,充分加热后干燥称重,固体的质量变为21.2g,试求:
(1)样品中NaHCO3的质量为___________g。
(2)向分解后的固体中加入2mol·L-1的盐酸,使之完全转化为NaCl,所需盐酸的体积至少为_______L。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚氯酸钠(NaClO2)主要用于棉纺、亚麻、腈纶、涤纶等纤维漂白(不适于羊毛、绢丝、粘胶丝、尼龙等),也可用于食品、饮用水消毒、纸张漂白和鱼药制造。工业上常用电解法生产亚氯酸钠(NaClO2),请根据下面的工艺流程图回答下列问题:

已知:纯的ClO2易分解爆炸。一般用稀有气体或空气稀释到10%以下安全。
(1)电解饱和NaCl溶液之前须除去其中的Ca2+、Mg2+、SO42-等杂质,依次加入BaCl2溶液、Na2CO3溶液、NaOH溶液,充分反应后将沉淀一并滤去,若经检测发现滤液中SO42-的浓度仍大于10-5mol·L -1,其可能的原因为____________________,滤液中c(CO32-)∶c(SO42-)为____________。[已知:Ksp(BaSO4 )= 1.0×10 -10,Ksp(BaCO3 )= 5.0×10-9 ]
(2)无隔膜电解槽内发生的反应中氧化产物、还原产物的物质的量之比为____________。
(3)将制得的ClO2 通入电解槽的阴极室,饱和NaCl溶液通入电解槽的阳极室,通电一段时间后可得到产品,电解时阴极的电极反应式为_____________________________。
(4)将ClO2 气体通入含CN-的电镀废水可得到对环境无污染的物质,反应的离子方程式为______________。
(5)ClO2溶液的浓度含量可用碘量法测定,其原理为在盐酸介质中ClO2与I-发生反应:2ClO2+8H++10I-=2Cl-+5I2+4H2O,再用Na2S2O3标准液滴定生成的I2,通过计算即可确定ClO2溶液浓度含量。已知:I2+2Na2S2O3=2NaI+Na2S4O6。
①滴定过程中需要滴加的指示剂为____________。
②取V1 mL的ClO2溶液加入到适量的盐酸和KI溶液中,反应完毕后再用0.lmol·L-1 的Na2S2O3溶液滴定反应后的溶液,若消耗了V2mL的Na2S2O3溶液,则ClO2 的浓度为____________ g·L-1。(杂质不参与反应,ClO2 的还原产物为Cl- )
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl3是一种常用的净水剂,某化学小组同学用如下装置制备无水FeCl3。已知无水FeCl3在空气中易潮解,加热易升华。请回答下列问题:
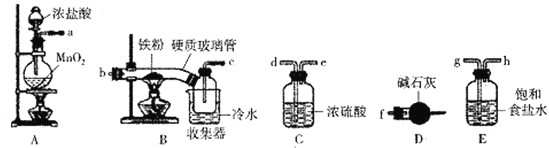
(1)装置A中发生的离子反应方程式为_______________________________。
(2)装置接口的连接顺序为____________ (用a、b、c……h表示)。
(3)装置B中收集器放在冷水中的作用为______________________。
(4)反应结束后,该小组同学对装置B中硬质玻璃管的右端进行加热,其目的是_________________。
(5)反应结束后,该小组同学将装置B中的残留物投入到足量盐酸中溶解.对所得溶液进行如下实验研究,请完成下表实验设计(药品自选)。
实验步骤 | 实验现象 | 实验结论 |
①取少许上述溶液,加入KSCN溶液 | ______ | 含有Fe3+ |
②取少许上述溶液,加入______ | 紫色溶液逐渐变浅至褪色 | _____ |
(6)工业上可用5.0mol·L-1的FeCl3溶液吸收H2S气体,若要吸收170gH2S气体;则需要该FeCl3溶液的体积为____________ mL。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com