
科目: 来源: 题型:
【题目】下列说法正确的是
A. 利用化石燃料燃烧放出的热量使水分解产生氢气,是氢能开发的研究方向
B. 光合作用是将光能转化为化学能的有效途径
C. 石油、煤、天然气属于二次能源
D. 绿色化学最显著的特征是在生产化工产品过程中必须利用绿色植物为原料
查看答案和解析>>
科目: 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是( )
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目: 来源: 题型:
【题目】关于酸、碱、盐的下列各种说法中,正确的是
A. 化合物电离时,生成的阳离子有氢离子的是酸
B. 化合物电离时,生成的阴离子有氢氧根离子的是碱
C. 化合物电离时,生成金属阳离子(或NH4+)和酸根离子的是盐
D. NH4Cl电离的电离方程式是:NH4Cl=NH4++Cl-,所以NH4Cl不是盐
查看答案和解析>>
科目: 来源: 题型:
【题目】以粗镍(含少量Fe和Cr杂质)为原料制备醋酸镍的工艺流程如下:
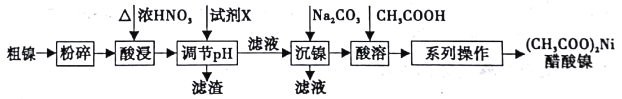
已知:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
回答以下问题:
(1)粗镍原料在酸浸前粉碎的原因是_______________。
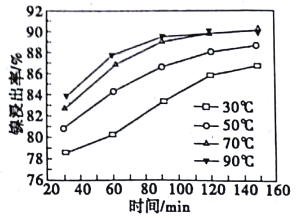
(2)酸浸过程中,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为_____℃、_____min。
(3)酸浸中Ni和浓硝酸反应的化学方程式为___________。
(4)加人试剂X为_____(填下列提供试剂的序号),可调节溶液pH至______(填pH范围)。
A.H2SO4 B.Cr2O3 C.NaOH D.Fe2O3
(5)进入“沉镍”步骤的滤液中c(Ni2+)=2.0mol/L,若要处理1L该滤液使Ni2+完全沉淀[c(Ni2+)≤10-5mol/L],则需要加入Na2CO3固体的质量最少为______g。(已知NiCO3的Ksp=9.6×10-6,结果保留小数点后2位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组利用硝酸和废铜屑(含Cu和CuO)作为原料制备硝酸铜,设计的流程如下:
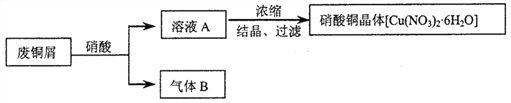
(1)某次实验使用了废铜屑共24g,用一定浓度的硝酸100mL完全溶解这些废铜屑时,共收集到标准状况下B气体6.72L(其中NO2和NO的体积比为2∶1)。请通过计算回答下列问题:
①废铜屑中铜和氧化铜的物质的量之比_____________。
②若测得溶液A中H+的浓度为1mol·L-1,则原硝酸的物质的量浓度为________________。(假设反应前后溶液的体积不变)
(2)上述制备方案中产生的气体B,既造成原料的浪费,也污染了环境。请你设计方案解决上述问题___________________________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】空气污染物通常以气态形式进入地面或低层大气环境。空气污染物与其主要来源不对应的是( )
污染物 | 来源 | |
A | HCHO | 家具生产与使用、质量低劣的涂料的使用 |
B | NO和NO2 | 飞机、汽车尾气 |
C | 悬浮颗粒物 | 建筑施工、燃煤的使用 |
D | SO2 | 雷电时在空气中产生 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于物质性质变化的比较,不正确的是( )
A.酸性强弱:H2SiO4<H2CO3<H3PO4
B.原子半径大小:Na>S>O
C.碱性强弱:KOH>NaOH>LiOH
D.还原性强弱:F﹣>Cl﹣>I﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇可作为燃料电池的原料.以CH4和H2O为原料,通过下列反应反应来制备甲醇.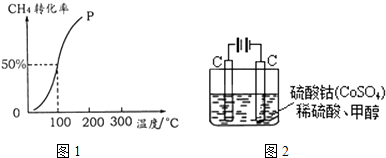
I:CH4 ( g )+H2O ( g )=CO ( g )+3H2 (g )△H=+206.0kJmol﹣1
II:CO ( g )+2H2 ( g )=CH3OH ( g )△H=﹣129.0kJmol﹣1
(1)CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的热化学方程式为 .
(2)将1.0molCH4和2.0molH2O (g )通入容积为100L的反应室,在一定条件下发生反应I,测得在一定的压强下CH4的转化率与温度的关系如图1.①假设100℃时达到平衡所需的时间为5min,则用H2表示该反应的平均反应速率为 .
②100℃时反应I的平衡常数为 .
(3)在压强为0.1Mpa、温度为300℃条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下发生反应II生成甲醇,平衡后将容器的容积压缩到原来的 ![]() ,其他条件不变,对平衡体系产生的影响是 (填字母序号).
,其他条件不变,对平衡体系产生的影响是 (填字母序号).
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.c ( H2 )/c (CH3OH )减小
E.平衡常数K增大
(4)写出甲醇﹣空气﹣KOH溶液的燃料电池负极的电极反应式: .
(5)甲醇对水质会造成一定的污染,有一种电化学法可消除这污染,其原理如图2.通电后,Co2+放电变为Co3+ , 然后以Co3+做氧化剂把水中的甲醇氧化成CO2而净化.①写出阳极电极反应式 .
②写出除去甲醇的离子方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列描述中,不符合生产实际的是( ) 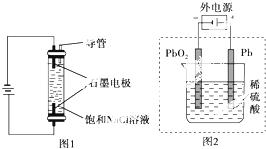
A.制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法
B.在镀件上电镀锌,用锌作阳极
C.用如图1装置生产家用消毒液(NaClO)
D.用如图2装置为铅蓄电池充
查看答案和解析>>
科目: 来源: 题型:
【题目】某地环保部门取一定量某工厂所排酸性废水试样分成甲、乙、丙、丁四份,进行如图所示探究。
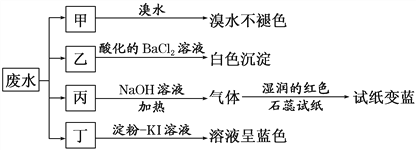
已知:废水试样中除H+外可能含有下表中的离子:
阳离子 | Na+、Mg2+、X |
阴离子 | Cl-、SO |
请回答下列问题:
(1)离子X是________________(填化学式,下同),离子Y是________________。
(2)表中不能确定是否存在的阴离子是________,能证明该阴离子是否存在的简单实验操作为____________________________________________________________________________。
(3)写出废水试样中滴加淀粉KI溶液所发生反应的离子方程式: _____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com