
科目: 来源: 题型:
【题目】25 ℃时,在20 mL 0.1 mol/L NaOH溶液中加入0.2 mol/L CH3COOH溶液,所加入溶液的体积(v)和混合液中pH变化关系的曲线如下图所示,若B点的横坐标a=10,下列分析的结论正确的是( )
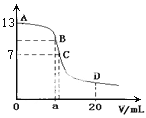
A. 在B点有:c(Na+)=c(CH3COO-)
B. 对曲线上A、B间任何一点,溶液中都有:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. C点时,c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
D. D点时,c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目: 来源: 题型:
【题目】锡为第IVA族具有可变价的金属元素,其单质沸点为2260℃。四氯化锡(SnCl4)是无色液体,熔点-33℃,沸点114℃,极易水解,在潮湿的空气中发烟。实验室中可用氯气与过量金属锡通过下图装置制备SnCl4 (夹持装置已略去)。
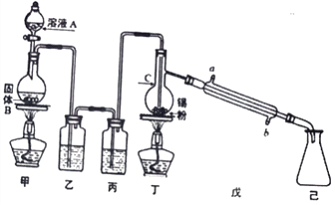
(1)仪器C的名称为___________,装置乙中的试剂是_____________。
(2)装置甲中发生反应的化学方程式为___________________________________。
(3)氯气与锡的反应类似与铁的反应,但该实验中对装置丁要持续加热,其原因是_____________。
(4)你认为该实验装置需要进行的改进是:__________________________________________。
(5)用下列方法和步骤测定所用金属锡样品的纯度(杂质不参加反应)
①将2.000g锡完全溶于过量稀盐酸中,并用所得溶液去还原过量的FeCl3稀溶液,最后得100.00mL 溶液。写出第二步反应的离子方程式:_____________________________。
②取①所得溶液amL用0.100 mol·L-1 的K2Cr2O7溶液滴定,发生如下反应:6FeCl2+ K2Cr2O7+ 14HCl=6FeCl3+2KCl+2CrCl3+7H2O。
K2Cr2O7溶液应注入到____式(填"酸或碱”) 滴定管中。到达滴定终点时用去bmL。则样品中锡的质量分数为_______%(用含a、b 的最简代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某含砷(As )的有毒工业废水经如下图流程转化为粗Aa2O3。已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
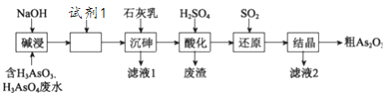
(1)加入试剂1的目的是:_________________________。
(2)“沉砷”是将砷元素转化为Ca5(AsO4)3OH 沉淀,发生的主要反应有:
A.Ca(OH)2(s) ![]() Ca2+(aq) + 2OH-(aq) ΔH <0
Ca2+(aq) + 2OH-(aq) ΔH <0
B.5Ca2+ + OH-+ 3AsO43-![]() Ca5(AsO4)3OH ΔH >0
Ca5(AsO4)3OH ΔH >0
研究表明:“沉砷”的最佳温度是85℃, 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是________。
(3)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是________。
(4)通过对H3AsO3溶液进行_____(填操作名称),再过滤可制得粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如下图所示。为控制滤液2 中As2O3的浓度不高于6×10-5 mol·L-1 ,则“结晶”过程应控制的条件是______________________(例举一例回答)
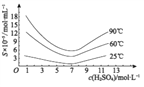
(5)从绿色化学和综合利用的角度考虑,对滤液2 处理方法是:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家最近在﹣100℃的低温下合成一种烃X,此分子的模型如图(图中的连线表示化学键),下列说法正确的是( ) 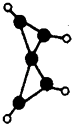
A.X能使溴的四氯化碳溶液褪色
B.X是一种在常温下能稳定存在的液态烃
C.X分子中在同一平面上的碳原子最多5个
D.充分燃烧等质量的X和甲烷,X消耗氧气多
查看答案和解析>>
科目: 来源: 题型:
【题目】A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解.
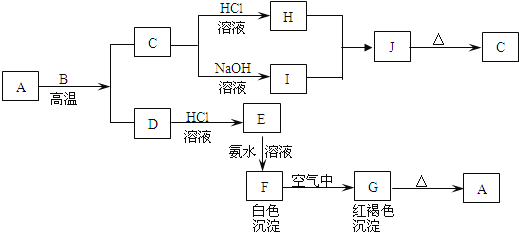
(1)写出下列物质的化学式:A:________,E:________,J:________,G:________.
(2)按要求写方程式:
①A与B在高温条件下生成C和D的化学方程式:________________________________;
②C转化为I的离子方程式:___________________________________________.
③F在空气中转化为G的化学方程式:__________________________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】某元素位于第三周期第ⅣA族.下列叙述不正确的是( )
A.该元素是金属元素
B.该元素原子的核电荷数为14
C.该元素原子核外有3个电子层
D.该元素原子不容易得到或者失去最外层电子
查看答案和解析>>
科目: 来源: 题型:
【题目】镁、铝及其化合物在生产生活中具有重要的应用.回答下列问题:
(1)工业上冶炼金属镁是采用惰性电极电解熔融MgCl2的方法,此时阴极的电极反应式为:;
(2)除去MgCl2溶液中的Fe2+ , 常加入少量H2O2 , 使Fe2+氧化为Fe3+ , 然后加入少量碱性物质至溶液pH=4,此时c(Fe3+)=mol/L[已知Fe(OH)3的Ksp=4×10﹣38]
(3)工业上冶炼金属铝则是采用惰性电极电解熔融Al2O3的方法,关于为什么不采用电解熔融AlCl3的方法的叙述正确的是(选择填空):
A.AlCl3是非电解质
B.AlCl3水溶液不导电
C.AlCl3是共价化合物
D.AlCl3熔点太高
(4)用碳棒做电极电解熔融Al2O3时,阳极需要定期更换,其原因是(用电极反应式和化学方程式回答);
(5)已知:Al2O3(熔融,l)=2Al(s)+ ![]() O2(g)△H=1600KJmol﹣1工业上利用惰性电极电解熔融Al2O3冶炼铝,每消耗1000kJ电能时,生成27gAl,则电解过程中能量利用率为 .
O2(g)△H=1600KJmol﹣1工业上利用惰性电极电解熔融Al2O3冶炼铝,每消耗1000kJ电能时,生成27gAl,则电解过程中能量利用率为 .
(6)明矾的化学式为KAl(SO4)212H2O,它可以作为净水剂,用离子方程式表示其能够净水的原因;向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH7(填>、<、=);
(7)若在空气中加热固体MgCl26H2O,可水解生成Mg(OH)Cl,写出相关的化学方程式 , 所以,为了抑制MgCl26H2O在加热时水解,可在干燥的气流中加热,可得到无水氯化镁.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com