
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
B. 0.1mol H2 和0.1molI2 于密闭容器中充分反应后,其分子总数为0.2NA
C. 常温下,1L pH=1的H2SO4溶液中的H+数目为0.2NA
D. 标准状况下,2.24 L苯所含分子数为0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】为探究乙烯与溴的加成反应,甲同学设计并进行了如下实验:先取一定量的工业用乙烯气体(在储气瓶中),使气体通入溴水中,发现溶液褪色,即证明乙烯与溴水发生了加成反应。乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊物质,推测在工业上制得的乙烯中还可能含有少量还原性的气体杂质,由此他提出必须先除去杂质,然后再使乙烯与溴水反应。
请你回答下列问题:
(1)甲同学的实验中有关的化学方程式为___________。
(2)甲同学设计的实验___(填“能”或“不能”)验证乙烯与溴发生加成反应,其理由是___(填编号)。
①使溴水褪色的反应,未必是加成反应
②使溴水褪色的反应,就是加成反应
③使溴水褪色的物质,未必是乙烯
④使溴水褪色的物质,就是乙烯
(3)乙同学推测此乙烯中必定含有的一种杂质气体是_____,它与溴水反应的化学方程式是________。在验证过程中必须全部除去杂质气体,除去该杂质的试剂可选用______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验小组的同学为探究和比较SO2和氯水的漂白性,设计了如下的实验装置。
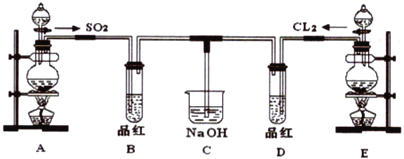
(1)实验室用装置A制备SO2,某同学在实验时发现打开A的分液漏斗活塞后,漏斗中液体未流下,你认为原因可能是:_________________________________________。
(2)实验室用装置E制备Cl2,其反应化学化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
①指出该反应中在反应中HCl(浓)所表现出的化学性质_____________、___________。
②请把(2)中的化学方程式改写为离子方程式_______________________________________。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现__________的现象(填选项,下同。
A.品红都褪色 B.品红都不褪色
C.试管B 中品红褪色D 中不褪色 D.试管D 中品红褪色B 中不褪色
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象又分别为__________。
A.无色 红色 B.无色 无色 C.红色 红色 D.红色 无色
(4)C 烧杯氢氧化钠溶液的作用是________________________。
(5)另一个实验小组的同学认为SO2 和氯水都有漂白性,二者混合后的漂白性肯定会更强,他们将制得的SO2和Cl2按1∶1同时通入到品红溶液中,结果发现褪色效果并不像想象的那样。请你分析该现象的原因(用化学方程式表示)_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
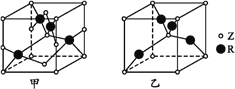
【题目】已知元素X、Y、Z、R为前四周期元素,且原子序数依次增大。X原子核外电子有6种不同的运动状态,s轨道电子数是p轨道电子数的两倍;Z原子L电子层上有2对成对电子,R+原子核外有3层电子且各层均处于全满状态。请回答下列问题:
(1)R基态原子的外围电子排布式为____,其基态原子有__种能量不同的电子。
(2)元素X、Y、Z的第一电离能由小到大的顺序为(用元素符号表示)____。
(3)与XYZ-互为等电子体微粒的化学式为______(写出一种即可),XYZ-的中心原子的杂化方式为_____。
(4)R2+与NH3形成的配离子中,提供孤对电子的原子是__。
(5)已知Z、R能形成两种化合物,其晶胞如图所示,甲的化学式为__,乙的化学式为__;高温时,甲易转化为乙的原因为_____________。
(6)若甲晶体中一个晶胞的边长为a pm,则甲晶体的密度为______g·cm-3(写出含a的表达式,用NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】钒是一种重要的合金元素,还用于催化剂和新型电池。从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如下:
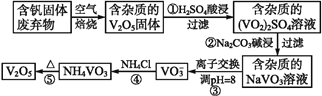
部分含钒化合物在水中的溶解性如下表:
物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
请回答下列问题:
(1)反应①所得溶液中除H+之外的阳离子有______。
(2)反应②碱浸后滤出的固体主要成分是______(写化学式)。
(3)反应④的离子方程式为__________。
(4)25 ℃、101 kPa时,4Al(s)+3O2(g)![]() 2Al2O3(s) ΔH1= —a kJ·mol-1,4V(s)+5O2(g)
2Al2O3(s) ΔH1= —a kJ·mol-1,4V(s)+5O2(g)![]() 2V2O5(s) ΔH2=—b kJ·mol-1。用V2O5发生铝热反应冶炼金属钒的热化学方程式是___________。
2V2O5(s) ΔH2=—b kJ·mol-1。用V2O5发生铝热反应冶炼金属钒的热化学方程式是___________。
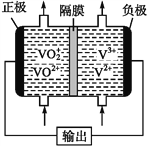
(5)钒液流电池(如下图所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过。电池放电时负极的电极反应式为_______,电池充电时阳极的电极反应式是________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钴(Co)及其化合物在工业上有广泛应用。为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质)。
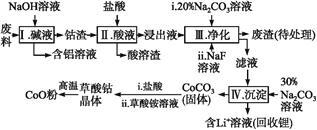
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表。
Fe3+ | Co2+ | Co3+ | Al3+ | |
pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是__________。
(2)写出步骤Ⅱ中Co2O3与盐酸反应生成Cl2的离子方程式:______。
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过______;废渣中的主要成分除了LiF外,还有______。
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是______。
(5)在空气中加热5.49 g草酸钴晶体(CoC2O4·2H2O)样品,受热过程中不同温度范围内分别得到一种固体物质,其质量如表。
温度范围/℃ | 固体质量/g |
150~210 | 4.41 |
290~320 | 2.41 |
890~920 | 2.25 |
①加热到210 ℃时,固体质量减轻的原因是__________。
②经测定,加热到210~290 ℃过程中的生成物只有CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
SiO2(s)+ C(s)+ N2(g)![]() Si3N4(s)+ CO(g)
Si3N4(s)+ CO(g)
(1)配平反应中各物质的化学计量数______,已知生成1 mol氮化硅(Si3N4)放出1 591.2 kJ的热量,该反应每转移1 mol e-,放出______kJ的热量。
(2)该反应的平衡常数表达式为K=____。升高温度,其平衡常数______(选填“增大”“减小”或“不变”)。
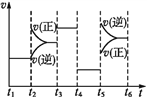
(3)该化学反应速率与反应时间的关系如上图所示,t2时引起v(正)突变、v(逆)渐变的原因是_________,t3引起变化的因素为_________,t5时引起v(逆)大变化、v(正)小变化的原因是_________。
(4)利用右图装置,可以模拟铁的电化学防护。
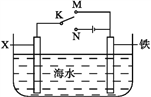
若X为碳棒,为减缓铁的腐蚀,开关K应置于___处。若X为锌,开关K置于M处,该电化学防护法称为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】CaC2、ZnC2、Al4C3、Mg2C3、Li2C2等同属于离子型碳化物,请通过CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是( )
A.Mg2C3水解生成C3H4
B.Li2C2水解生成C2H4
C.Al4C3水解生成C3H4
D.ZnC2水解生成C2H
查看答案和解析>>
科目: 来源: 题型:
【题目】根据反应 MnO2+4HCl(浓)== MnCl2+Cl2↑+2H2O,回答下列问题:
①还原剂是________,还原产物是________.
②氧化剂是________,氧化产物是________.
③在标准状况下有44、8L Cl2生成时,被氧化的物质是________mol
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子.
(1)Y基态原子的电子排布式是;Z所在周期中第一电离能最大的主族元素是
(2)XY2﹣离子的立体构型是;R2+的水合离子中,提供孤电子对的原子是 .
(3)Z与某元素形成的化合物的晶胞如图所示,晶胞中阴离子与阳离子的个数比是 . 
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2 , 充分反应后溶液呈深蓝色,该反应的离子方程式是 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com