
科目: 来源: 题型:
【题目】I.A、B、C、D均为中学化学常见的纯净物,A是单质,它们之间有如下的反应关系;
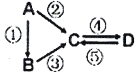
(1)若B是气态氢化物,C、D是氧化物且会造成光化学烟雾污染,B与C在一定条件下反应生成的A是大气的主要成分,写出B-C的化学方程式:_______________。
(2)若D物质具有两性,②、③反应均要用强碱溶液,④反应是通入过量的一种引起温室效应的主要气体,写出A→C的离子方程式:______________________。
(3)若A是制作芯片常用材料,B为A单质的氧化物,C为水玻璃的主要成分.写出A→C的离子方程式:__________________________。
(4)若A是应用最广泛的金属.④反应用到A,②、⑤反应均用到同一种非金属单质,C的溶液用于蚀刻印刷铜电路板,写出C→D的离子方程式:__________________。
(5)若A为淡黄色固体,C、D是氧化物,且是是造成酸雨的主要物质,B与C可反应生成A。写出B完全燃烧的化学方程式:__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】今有6.02×1024个CO2,这些分子的物质的量是________mol,这些分子的质量是_______g,这些分子在标准状况下的体积是____________升,其中氧原子的个数是_____________个(NA可取6.02×1023mol-1)。
查看答案和解析>>
科目: 来源: 题型:
【题目】冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。请回答下列问题:

(1)Ti的原子序数为22,Ti位于元素周期表中第_______周期。
(2)写出钛铁矿在高温下与焦炭经氯化得到四氯化钛的化学方程式_______________。
(3)制备TiO2的方法之一是利用TiCl4水解生成TiO2·x H2O,再经焙烧制得。水解时需加入大量的水并加热,请结合化学方程式和必要的文字说明原因:_________________________________________。
(4)由TiCl4→Ti 需要在Ar气中进行的理由是_________________________________。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据下表信息,需加热的温度略高于___________℃即可。
TiCl4 | Mg | MgCl2 | Ti | |
熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+ ,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为M g/mol)试样w g,消耗c mol/L NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数为___________________。(用代数式表示)
(6)由CO和H2合成甲醇的方程式是:CO(g)+2H2(g) ![]() CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 ____mol。
CH3OH(g)。若不考虑生产过程中物质的任何损失,上述产业链中每合成6mol甲醇,至少需额外补充H2 ____mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,将体积为Va、pH=a的某一元酸与体积Vb、pH=b的某一元碱混合,请完成下列各题.
(1)若a+b=14,2Va=Vb , 碱是NaOH,反应后所得溶液pH小于7.由此你能得到的结论是 .
(2)若a+b=13,酸是盐酸,碱是b=12的KOH,现用盐酸滴定50.00mL KOH溶液,当滴定到溶液的pH=2时,消耗盐酸的体积V=mL.
(3)若已知Va<Vb和a=0.5b,酸是强酸,碱是强碱,酸和碱恰好中和,则a的取值范围是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】我国产铜主要取自黄铜矿(CuFeS2),湿法炼铜工艺的核心是黄铜矿的浸出,目前主要有氧化浸出、配位浸出和生物浸出三种方法。
I.氧化浸出
(1)在硫酸介质中用双氧水将黄铜矿氧化,测得有SO42-生成。
①该反应的离子方程式为________________________________.
②该反应在25—50℃下进行,实际生产中双氧水的消耗量要远远高于理论值,试分析其原因为__________________________________________________
Ⅱ,配位浸出
反应原理为:CuFeS2+NH3·H2O+O2+OH-→ Cu(NH3)42++Fe2O3+SO42-+H2O(未配平)
(2)用化学用语解释氨水溶液的酸碱性______________________________.
(3)生产中为了稳定溶液的pH,可以在浸出液加入___________________(物质名称)Ⅲ.生物浸出
在反应釜中加入黄铜矿、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,反应釜中各物质的转化关系如图所示。
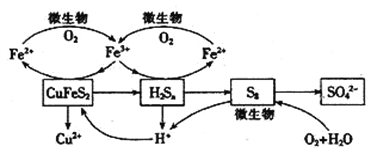
(4)在微生物的作用下,可以循环使用的物质有_________(填化学式),微生物参与的离子反应方程式为_______________________________(任写一个)。
(5)假如黄铜矿中的铁元素最终全部转化为Fe3+,当有2 mol SO42-生成时,理论上消耗O2的物质的量为_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D四种元素,它们原子的核电荷数均小于18,且依次增大,A原子核内仅有一个质子;B原子的电子总数与D原子的最外层电子数相等;A原子与B原子最外层电子数之和与C原子的最外层电子数相等;D原子有两个电子层,最外层龟子数是次外层电子数的3倍。
(1)试推断它们各是什么元素? 写出它们的元素符号:A______,B________,C_______,D_______。
(2)甲、乙、丙、丁是由以上四种元素中的几种组成的10 电子微粒;
①甲为分子,且能刻蚀玻璃,则甲的化学式为______
②乙为气体,且遇到无色酚酞溶液变成红色,则乙的化学式为_______
③丙为阳离子,丁为阴离子,且丙和丁在加热条件下生成的两种物质也是10电子微粒,请写出该反应的离子方程式_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】脂肪烃CnHm分子中,碳碳原子间共用电子对数为(用含n、m的式子表示).若某脂肪烃分子中,碳碳原子间共有电子对数为28,且分子内含一个双键和一个叁键,则它的分子式为 . 若将Cn看做烃分子中的氢原子完全失去后的产物,则C60中碳碳原子间共用电对数为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】电解Na2PbCl4溶液,生成Pb,装置如下图,下列说法不正确的是
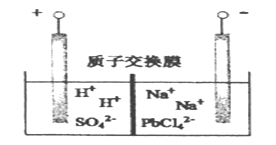
A. 阴极的电极反应式为 PbCl42- +2e- =Pb + 4Cl-
B. 电解一段时间后,Na2PbCl4浓度极大下降,可加入PbO恢复其浓度
C. 电解过程中阳极溶液的pH减小,阴极的pH保持不变
D. 电路中通过0.2mol,则阴极的质量增加20.7g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com