
科目: 来源: 题型:
 ) 为主要原料合成对羟基苯甲醛(
) 为主要原料合成对羟基苯甲醛(  ) 的工艺 流程如图所示.
) 的工艺 流程如图所示.








查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:

| 成分 | 质量 | 判断依据或计算推理过程 | ||||
| Al | 2.7g 2.7g |
2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 54g 67.2L m(Al) 3.36L m(Al)=54g×
2Al+2NaOH+2H2O=2NaAlO2+3H2↑ 54g 67.2L m(Al) 3.36L m(Al)=54g×
| ||||
| (NH4)2SO4 | 6.6g 6.6g |
(NH4)2SO4+2NaOH=2Na2SO4+2H2O+2NH3↑ 132g 44.8L m[(NH4)2SO4]2.24L m[(NH4)2SO4]=132g×
(NH4)2SO4+2NaOH=2Na2SO4+2H2O+2NH3↑ 132g 44.8L m[(NH4)2SO4]2.24L m[(NH4)2SO4]=132g×
| ||||
| MgCl2 | 4.75 4.75 |
MgCl2+2NaOH=Mg(OH)2↓+2NaCl 95g58g m[MgCl2]2.9g m[MgCl2]=95g×
MgCl2+2NaOH=Mg(OH)2↓+2NaCl 95g58g m[MgCl2]2.9g m[MgCl2]=95g×
| ||||
| FeCl2 | 0 0 |
Fe(OH)2在空气中会转化为红褐色Fe(OH)3,但步骤③中白色沉淀久置无明显变化 Fe(OH)2在空气中会转化为红褐色Fe(OH)3,但步骤③中白色沉淀久置无明显变化 | ||||
| AlCl3 | 0 0 |
原固体中Al、(NH4)2SO4和MgCl2三种物质的质量之和刚好等于14.05g,所以一定没有AlCl3 原固体中Al、(NH4)2SO4和MgCl2三种物质的质量之和刚好等于14.05g,所以一定没有AlCl3 |
查看答案和解析>>
科目: 来源: 题型:
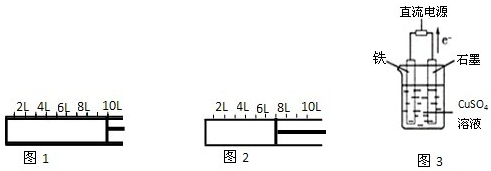
查看答案和解析>>
科目: 来源: 题型:
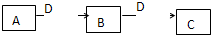 (2009?潍坊一模)A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素.在一定条件下相互转化关系如下图所示(部分产物已略去).请按要求回答下列问题:
(2009?潍坊一模)A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素.在一定条件下相互转化关系如下图所示(部分产物已略去).请按要求回答下列问题:| 催化剂 |
| 加热 |
| 催化剂 |
| 加热 |
查看答案和解析>>
科目: 来源: 题型:
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| 高温高压 |
| ||
| 高温高压 |
查看答案和解析>>
科目: 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com