
科目: 来源: 题型:
【题目】2013年10月世界卫生组织癌症专门机构首次指认大气污染“对人类致癌”。下列行为有利于防止大气污染、遏制雾霾天气发生的是( )
A. 在田间焚烧秸杆
B. 冬季燃烧大量烟煤供热取暖
C. 提倡开私家车出行,减少乘坐公交车
D. 改善能源结构,大力发展太阳能、风能等清洁能源
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子能共存的是:
A.K+、Cl-、HCO3-、H+B.NH4+、Cl-、OH-、SO42-
C.Na+、Cl-、Fe3+、NO3-D.Ba2+、Cl-、Al3+、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分 | 含量/(mg·L-1) | 成分 | 含量/(mg·L-1) |
Cl- | 18980 | Ca2+ | 400 |
Na+ | 10560 | HCO3- | 142 |
SO42- | 2560 | Br- | 64 |
Mg2+ | 1272 |
(1)电渗析法淡化海水示意图如下图所示;其中阴(阳)离子交换膜仅允许阴(阳)离子通过。

①阳极主要电极反应式是____________。
②在阴极附近产生少量白色沉淀,两种主要的成分为____________。
③淡水的出口为_______(填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下:

①从MgCl2·6H2O晶体得到无水MgCl2的主要实验操作是_______________。
②依据上述流程,若将0.5m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为_________L(忽略Cl2溶解)。
查看答案和解析>>
科目: 来源: 题型:
【题目】电解质水溶液中可存在电离平衡,水解平衡,溶解平衡,依据所学回答下列问题.
(1)等物质的量浓度的下列四种溶液:①NH3H2O ②(NH4)2SO3 ③KHSO3 ④K2SO3溶液中水的电离程度由大到小的排列顺序为(填序号).
(2)体积相同、c(H+)相同的三种酸溶液①CH3COOH;②HCl;③H2SO4分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是(填序号).将c(H+)相同的三种酸均加水稀释至原来的10倍,c(H+)由大到小的顺序为(填序号).
(3)已知,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣57.3kJ/mol.实验测得稀醋酸与稀NaOH溶液反应生成1mol H2O时放出57kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为 .
(4)25℃时,NH3H2O的电离常数为Kb=1.7×10﹣3 . 0.1molL﹣1NH4Cl溶液的pH=a,则c(NH4+):c(NH3H2O)=(用含a的代数式表示)
(5)某化学研究性学习小组对电解质溶液作如下归纳总结(均在常温下),其中正确的有①pH=1的强酸溶液,加水稀释后,溶液中各离子浓度一定都降低②pH=2的盐酸与pH=13的NaOH溶液,按体积比9:1混合后的溶液pH为11
③pH相等的三种溶液:a.CH3COONa;b.NaHCO3;c.NaOH.其溶液物质的量浓度由小到大顺序为c、b、a
④NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42﹣)
⑤亚磷酸(H3PO3)是二元弱酸,所以Na2HPO3稀溶液一定呈碱性
⑥甲、乙两溶液都是强电解质,已知甲溶液的pH是乙溶液pH的两倍,则甲、乙两溶液等体积混合,混合液pH可能等于7.
⑦某二元酸在水中的电离方程式是H2B═H++HB﹣;HB﹣H++B2﹣ , 则0.1mol/L的Na2B溶液中,c(Na+)=2c(B2﹣)+2c(HB﹣)
(6)25℃时Ksp[Mg(OH)2]=5.6×10﹣12 , Ksp[Cu(OH)2]=2.2×10﹣20 , Ksp[Fe(OH)3]=4.0×10﹣38 , Ksp[Al(OH)3]=1,.1×10﹣33 . 在25℃下,向浓度均为0.1molL﹣1的AlCl3和CuCl2混合溶液中逐滴加入氨水,先生成沉淀(填化学式).现向一定浓度的AlCl3和FeCl3的混合溶液中逐滴加入氨水,当Fe3+刚好完全沉淀时,测定c(Al3+)=0.2molL﹣1 . 此时所得沉淀中(填“还含有”或“不含有”)Al(OH)3 .
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是重要的化工原料,利用CO2和H2合成甲醇,发生的主反应如下:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H
已知:在 25℃、101kPa 下,1g 甲醇燃烧生成 CO2和液态水时放热 22.70kJ.
(1)请写出表示甲醇燃烧热的热化学方程式 .
(2)在一恒温恒容密闭容器中充入1mol CO2和3molH2进行上述反应.测得CO2和CH3OH(g)浓度随时间变化如图1所示.回答:0~10min内,氢气的平均反应速率为mol/(Lmin);第10min 后,保持温度不变,向该密闭容器中再充入0.75mol CO2(g)和1.5molH2O(g),则平衡(填“正向”、“逆向”或“不”)移动.恒温恒压密闭容器中该反应达平衡状态的依据是(填序号) .
A.v正(CH3OH)=3v逆(H2) B.混合气体的密度不变
C.c(CH3OH)=c(H2O) D.混合气体的总物质的量不变
(3)如图2,25℃时以甲醇燃料电池(电解质溶液为稀硫酸)为电源来电解300mL某NaCl溶液,该装置中 a 极为极,负极反应式为 . 在电解一段时间后,NaCl溶液的pH值变为12(假设NaCl 溶液的体积不变),则理论上消耗甲醇的物质的量为mol.
(4)取五份等体积的CO2和H2的混合气体(物质的量之比均为1:3),分别加入温度不同、容积相同的恒容密闭容器中,发生上述反应,反应相同时间后,测得甲醇的体积分数φ(CH3OH)与反应温度T的关系曲线如图3所示,则上述CO2转化为甲醇的反应的△H0(填“>”、“<”或“=”).
查看答案和解析>>
科目: 来源: 题型:
【题目】W结构中含有三个六元环,是一种新型香料的主要成分之一.W的合成路线如下(部分产物和部分反应条件略去):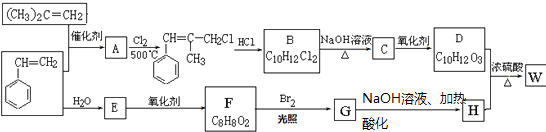 ,
,
已知:①RCH═CH2+CH2═CHR′ ![]() CH2═CH2+RCH═CHR′
CH2═CH2+RCH═CHR′
②B中核磁共振氢谱图显示分子中有6种不同环境的氢原子
③D和H是同系物,D与H发生反应生成W.
请回答下列问题:
(1)G分子中含有的官能团名称是 .
(2)A→B反应过程中涉及的反应类型有、 .
(3)A的结构简式为; F的结构简式为;
(4)B→C的化学方程式为;D+H→W的化学方程式为 .
(5)K为F的同系物,碳数比F多1,其符合下列条件的K的同分异构体共有种.a.能发生银镜反
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
(6)K的所有同分异构体在下列﹣种表征仪器中显示的信号(或数据)完全相同,该仪器是(填标号).a.质谱仪 b.红外光谱仪 c.元素分析仪 d.核磁共振仪.
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E均为短周期主族元素,B、C、D在周期表中的位置关系如下图所示。A是短周期中原子半径最小的元素,A、B、C三种元素的原子序数之和等于D元素的原子序数,E是短周期中最活泼的金属元素。下列说法错误的是
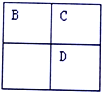
A. 简单离子的半径大小关系:B>C>E
B. 由C、E两种元素组成的两种离子化合物中,阴、阳离子个数比均为1:2
C. C元素的气态氢化物比D元素的气态氢化物稳定是氢键的缘故
D. 已知A、B两种元素组成的离子化合物NH5与水生成气体A2及一种弱碱溶液,推出离子化合物NH5中阴、阳离子个数比为1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关碱金属、卤素结构和性质描述正确的是
①随着核电荷数的增加,碱金属单质、卤素单质的熔沸点依次升高,密度依次增大
②F、Cl、Br、I的最外层电子数都是7,次外层电子数都是8
③碱金属单质的金属性很强,均易与氧气发生反应,加热时生成氧化物R2O
④根据同族元素性质的递变规律推测At 与H化合较难,砹化银也难溶于水且具有感光性。
⑤根据F、Cl、Br、I的非金属性递减,可推出HF、HCl、HBr、HI的还原性、水溶液酸性均依次增强而热稳定性依次减弱。
⑥碱金属都应保存在煤油中
⑦卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是随着核电荷数增加,电子层数增多,原子半径增大起主要作用
⑧碳酸铯不易发生分解反应生成氧化铯和二氧化碳
A. ④⑦⑧ B. 全部正确 C. ⑤⑥⑦ D. ①③⑦⑧
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com