
科目: 来源: 题型:
【题目】李时珍在《本草纲目》中写到“烧酒非古法也,自元时始创其法。用浓酒精和糟入甑,蒸令气上,用器承取滴露。”文中涉及的操作方法是
A.分液B.萃取C.过滤D.蒸馏
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)在这些元素中,金属性最强的元素是_____,最活泼的非金属元素是_______________
(2)化学性质最不活泼的元素是______________,其原子的原子结构示意图为___________;
(3)元素的最高价氧化物对应的水化物中酸性最强的是______________,碱性最强的是____________,
(4)在③~⑦元素中,原子半径最大的是________,原子半径最小的是_______;
查看答案和解析>>
科目: 来源: 题型:
【题目】已知某透明澄清的溶液中可能含有NO3- 、Cl- 、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,同时产生红褐色沉淀; ②将沉淀过滤、洗涤、灼烧,得到1.6 g固体; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。下列说法正确的是
A. 不能确定原溶液中是否含有Al3+和K+
B. 原溶液中含有的离子只有:Cl- 、SO42-、NH4+、Fe3+
C. 原溶液中c(NO3-)=0.2 mol·L-1 c(Fe3+)=0.2 mol·L-1
D. 在原溶液中加入足量的铁粉所得溶液中阳离子所带正电荷数减少
【答案】C
【解析】①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,说明溶液中含有0.02mol NH4+,同时产生红褐色沉淀为氢氧化铁,说明溶液中含有Fe3+,CO32-与Fe3+会发生双水解而不能大量共存,故溶液中一定不含CO32-;②将沉淀过滤、洗涤、灼烧,得到1.6 g固体为氧化铁,则n[Fe(OH)3]=2n(Fe2O3)=2×![]() =0.02mol; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀,则沉淀为硫酸钡,n(SO42-)=n(BaSO4)=
=0.02mol; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀,则沉淀为硫酸钡,n(SO42-)=n(BaSO4)= ![]() =0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中还有其他阴离子,且所含阴离子的物质的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,选项A错误;B. 原溶液中含有的离子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,选项B错误;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,选项C正确;D. 在原溶液中加入足量的铁粉,发生反应:2Fe3++ Fe = 3Fe2+所得溶液中阳离子所带正电荷数基本不变,选项D错误。答案选C。
=0.02mol。n(+)=n(NH4+)+3n(Fe3+)=0.02mol+3×0.02mol=0.08mol,n(-)=2 n(SO42-)=2×0.02mol=0.04mol<0.08mol,故溶液中还有其他阴离子,且所含阴离子的物质的量相等,故n(-)=2 n(SO42-)+n(NO3-)+n(Cl-)=2×0.02mol+0.02mol+0.02mol=0.08mol,因此溶液中一定含有NO3- 、Cl-,一定不含Al3+和K+。故A.原溶液中一定不含Al3+和K+,选项A错误;B. 原溶液中含有的离子只有:NO3- 、Cl- 、SO42-、NH4+、Fe3+,选项B错误;C. 原溶液中c(NO3-)=0.2 mol·L-1,c(Fe3+)=0.2 mol·L-1,选项C正确;D. 在原溶液中加入足量的铁粉,发生反应:2Fe3++ Fe = 3Fe2+所得溶液中阳离子所带正电荷数基本不变,选项D错误。答案选C。
【题型】单选题
【结束】
8
【题目】根据要求回答下列问题:
(1)已知恒温、恒容条件下发生反应:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
①下列图像说明该反应进行到t1时刻未达平衡状态的是________(填选项字母)。
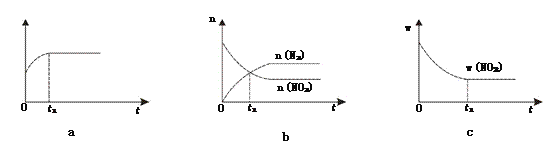
②1 molNO2和足量C发生反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示。
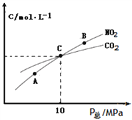
图中A、B、C三点NO2的转化率最高的是_____,该反应的平衡常数Kp=_______(Kp是用平衡分压代替平衡浓度的常数,分压=总压×物质的量分数)。
(2)已知:弱电解质的电离平衡常数为
物质 | H2CO | H2S | HNO2 |
电离平衡常数 (25℃) | Ka1=4.2×10-7 Ka2=5.61×10-11 | Ka1=1.3×10-7 Ka2=7.1×10-15 | Ka=5.1×10-4 |
①含有1L 2mol·L-1碳酸钠的溶液中加入1L 1mol·L-1的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是_______。
②25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。pH=13时,溶液中的c(H2S)+c(HS-)=____mol·L-1;
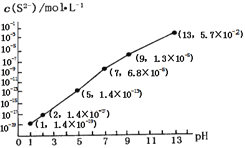
③向10.00mL0.10 mol·L-1的氢硫酸中滴加10.00mL0.1 mol·L-1NaOH溶液,溶液呈_____性,其定量依据是______________________ .
(3)已知:①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+4CO(g)![]() CaS(s)+4CO2(g) △H= -189.2kJmol-1
CaS(s)+4CO2(g) △H= -189.2kJmol-1
则:CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H=_______kJmol-1.
CaS(s)+3CO2(g) △H=_______kJmol-1.
查看答案和解析>>
科目: 来源: 题型:
【题目】下图所示装置可间接氧化工业废水中含氮离子(NH4+)。下列说法不正确的是
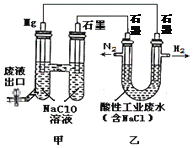
A. 乙是电能转变为化学能的装置
B. 含氮离子氧化时的离子方程式为:3Cl2 + 2NH4+=N2 + 6Cl-+8H+
C. 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH减小
D. 电池工作时,甲池中的Na+移向Mg电极
【答案】D
【解析】A、甲中活泼金属镁作原电池的负极,石墨为正极形成原电池,乙是连接原电池的电解池,电解酸性工业废水,电解池是将电能转变为化学能的装置,选项A正确;B、酸性条件下含氮离子氧化时转化为氮气,反应的离子方程式为:3Cl2 + 2NH4+=N2 + 6Cl-+8H+,选项B正确;C、若生成H2和N2的物质的量之比为3:1,根据电极反应6H++6e-=3H2↑、3Cl2 + 2NH4+=N2 + 6Cl-+8H+,则处理后废水的H+浓度增大,pH减小,选项C正确;D、电池工作时,甲池是原电池,原电池中阳离子Na+移向正极石墨电极,选项D不正确。答案选D。
【题型】单选题
【结束】
7
【题目】已知某透明澄清的溶液中可能含有NO3- 、Cl- 、SO42-、CO32-、NH4+、Fe3+、Al3+和K+中的几种,且所含阴离子的物质的量相等。为确定该溶液的成分,某学习小组做了如下实验:①取该溶液100mL,加入过量NaOH溶液,加热得到0.02mol气体,同时产生红褐色沉淀; ②将沉淀过滤、洗涤、灼烧,得到1.6 g固体; ③向上述滤液中加入足量BaCl2溶液,得到4.66 g不溶于盐酸的沉淀。下列说法正确的是
A. 不能确定原溶液中是否含有Al3+和K+
B. 原溶液中含有的离子只有:Cl- 、SO42-、NH4+、Fe3+
C. 原溶液中c(NO3-)=0.2 mol·L-1 c(Fe3+)=0.2 mol·L-1
D. 在原溶液中加入足量的铁粉所得溶液中阳离子所带正电荷数减少
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F是原子序数依次增大的短周期主族元素。E是同周期元素金属性最强的元素。甲、乙、丙、丁、戊是由上述部分元素中的两种或几种组成的化合物,它们的转化关系如图所示。其中甲是生活中的调味品,丁是淡黄色固体。下列说法不正确的是
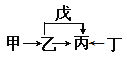
A. 原子半径由大到小的顺序为:r(E)>r(F)>r(C)>r(D)
B. 元素F的氧化物的水物化的酸性一定比硫酸酸性强
C. 元素B的氢化物可能具有正四面体结构
D. 化合物A4BC2D既可能是共价化合物,也可是离子化合物
【答案】B
【解析】A、B、C、D、E、F是原子序数依次增大的短周期主族元素。E是同周期元素金属性最强的元素,则E为钠元素;根据流程图推导,且甲是生活中的调味品,丁是淡黄色固体,可知甲为氯化钠,丁为过氧化钠,则丙为碳酸钠,乙为氢氧化钠,戊是二氧化碳,则A、B、C、D、E、F分别为H、C、N、O、Na、Cl。A. 同周期性元素从左到右原子半径逐渐减小,同主族元素从上而下原子半径逐渐增大,故原子半径由大到小的顺序为:r(Na)>r(Cl)>r(N)>r(O),选项A正确;B. 元素Cl的最高价氧化物的水物化的酸性一定比硫酸酸性强,若不是最高价氧化物的水化物,则可能比较弱,如HClO是弱酸,选项B不正确;C. 元素B的氢化物CH4具有正四面体结构,选项C正确;D. 化合物A4BC2D既可能是共价化合物CO(NH2)2,也可是离子化合物NH4CNO,选项D正确。答案选B。
【题型】单选题
【结束】
6
【题目】下图所示装置可间接氧化工业废水中含氮离子(NH4+)。下列说法不正确的是

A. 乙是电能转变为化学能的装置
B. 含氮离子氧化时的离子方程式为:3Cl2 + 2NH4+=N2 + 6Cl-+8H+
C. 若生成H2和N2的物质的量之比为3:1,则处理后废水的pH减小
D. 电池工作时,甲池中的Na+移向Mg电极
查看答案和解析>>
科目: 来源: 题型:
【题目】下列水解方程式的书写中,正确的是( )
A.CH3COO﹣的水解方程式:CH3COO﹣+H2O?CH3COOH+OH﹣
B.HCO3﹣的水解方程式:HCO ![]() +H2O?CO
+H2O?CO ![]() +H3O+
+H3O+
C.CO ![]() 的水解方程式:CO
的水解方程式:CO ![]() ?+2H2O?H2CO3+2OH﹣
?+2H2O?H2CO3+2OH﹣
D.Fe3+的水解方程式:Fe3++3OH﹣?Fe(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】同一周期的A、B、C、D、E为原子序数依次增大的短周期元素,已知A、B、E 3种原子最外层共有11个电子,且这3种元素的最高价氧化物的水化物两两皆能发生反应生成盐和水,C元素的最外层电子数比次外层电子数少4,D元素原子次外层电子数比最外层电子数多3。
(1)写出下列元素符号:A ____________ ,B_____________,C____________,D___________,E_____________
(2)A与E两元素可形成化合物,用电子式表示其化合物的形成过程:________________________________
(3)写出A、B两元素最高价氧化物对应的水化物相互反应的化学方程式:___________________________________
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D四种短周期元素,其原子序数依次增大,其中B与C同周期,A与D同主族,C元素的原子最外层电子数是次外层电子数的三倍,又知四种元素所形成的常见单质在常温常压下有三种是气体,一种是固体.请回答下列问题.
(1)固体甲是由元素B、A形成的化合物BA5 , 它的所有原子的最外层都符合相应的稀有气体原子的最外层电结构,固体甲溶解于水有气体放出.则固体甲属于晶体,它的电子式为 . 固体甲溶于水后,溶液呈(酸、碱或中性),写出甲与水反应的化学方程式 .
(2)由C和D形成的化合物乙溶于水能生成一种气体,写出乙与水反应的化学方程式 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com