
科目: 来源: 题型:
【题目】实验室需配制500 mL 1 mol /L NaOH溶液,下列叙述正确的是
A.用托盘天平称量20.0 g NaOH固体
B.溶解后不需要冷却至室温,可立即转移至容量瓶
C.转移溶液时不需要使用玻璃棒引流
D.定容完毕并摇匀后发现液面低于刻度线,再补加几滴水至刻度线,对实验结果无影响
查看答案和解析>>
科目: 来源: 题型:
【题目】图1为某套实验装置的示意图,其中加热装置和部分药品等均已省略(装置Ⅰ和装置Ⅱ为气体发生装置)。
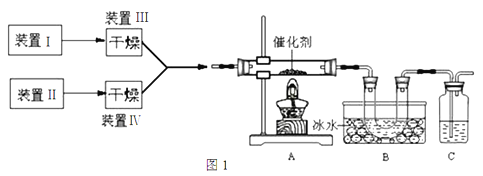
(1)甲同学用此装置(在A、B间增加一盛有浓硫酸的洗气瓶)
制备NO2并验证其性质。
①装置Ⅰ用于实验室制备NH3,装置Ⅱ制备过量O2。装置Ⅰ中发生反应的化学方程式为_____________________。
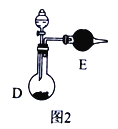
②也可以将制气体装置Ⅰ、Ⅱ、Ⅲ、Ⅳ合并为一个装置,如图2所示。若分液漏斗中盛装浓氨水,则D中的固体试剂为_______(填化学式),E中的试剂为____________。
(2)乙同学用此套装置合成SO3,B装置U形管中有固体出现。
①实验室可用铜和浓硫酸加热或硫酸和亚硫酸钠反应制取二氧化硫。 若用硫酸和亚硫酸钠反应制取3.36L(标准状况)二氧化硫,如果已有25.0%的亚硫酸钠(质量分数)被氧化为硫酸钠,则至少需称取该亚硫酸钠的质量为______g(保留一位小数)。
②现欲制得纯净干燥的SO3,若图1装置C中盛放NaOH溶液,则此装置中存在明显不足:
a.C中的水蒸气可能进入B中与SO3反应;b.____________________________________。
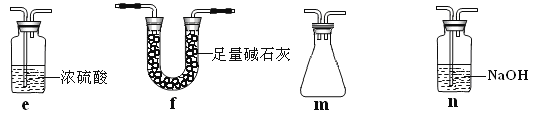
应如何改进:______________________________(从下图给出的实验装置中选择字母标号补充或替换,并用简要文字说明补充和替换的位置)。
(3)丙同学拟验证NO能被氨气还原并测算其转化率(装置Ⅰ、装置Ⅱ分别制取NO和NH3),将图1装置中A、B、C分别换成图5中装置Ⅴ、Ⅵ、Ⅶ。
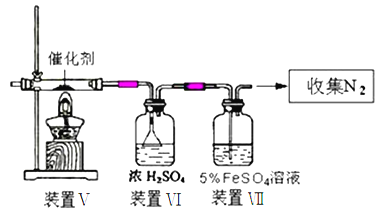
①写出氨气被NO氧化的化学方程式:___________________________。
②装置Ⅶ的作用可能是__________________________。
③若进入装置Ⅴ的NO共22.4L(已折算为标准状况,下同),氨气过量,最后收集到11.2LN2,则NO的转化率是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】国庆70周年阅兵式,大量新式武器新鲜出炉且都为中国制造,制造这些“国之重器”的材料多为合金。下列关于合金的说法不正确的是
A.合金在工业上的用途比纯金属更广
B.合金的硬度一般比它的成分金属大
C.合金的熔点一般比它的成分金属高
D.合金与各成分金属相比,具有许多优良的物理、化学或机械性能
查看答案和解析>>
科目: 来源: 题型:
【题目】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质 | V2O5 | V2O4 | K2SO4 | SiO2 | Fe2O3 | Al2O3 |
质量分数/% | 2.2~2.9 | 2.8~3.1 | 22~28 | 60~65 | 1~2 | <1 |
以下是一种废钒催化剂回收工艺路线:
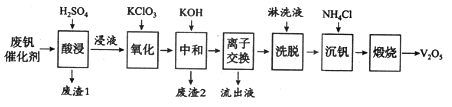
回答下列问题:
(1)五氧化二钒是一种催化剂,可将SO2转化为SO3,请写出该反应的化学方程式____________。
(2)“酸浸”时V2O5转化为VO2+,反应的离子方程式为_________________________,同时V2O4转成VO2+。“废渣1”的主要成分是_____________。
(3)“氧化”中欲使3 mol的VO2+变为VO2+,则需要氧化剂KClO3至少为______mol。
(4)“中和”作用之一是使钒以V4O124—形式存在于溶液中。“废渣2”中含有_______。
(5)“流出液”中阳离子最多的是________。
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有25℃时0.1mol/L的氨水,请回答以下问题:
①若向氨水中加入少量硫酸铵固体,此时溶液中 ![]() (填“增大”,“减小”或“不变”).
(填“增大”,“减小”或“不变”).
②若向氨水中加入稀硫酸,使其恰好中和,所得溶液的pH7(填“>”“<”或“=”),用离子方程式表示其原因: .
③若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42﹣)为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列措施不能加快Zn与1mol/LH2SO4反应产生H2的速率的是( )
A.升高温度
B.用Zn粉代替Zn粒
C.滴加少量的CuSO4溶液
D.改用0.1mol/LH2SO4与Zn反应
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上,向500℃左右的铁屑中通入Cl2生产无水氯化铁,其制备过程中均要确保无水。现模拟该过程用图示装置进行实验:

(1)仪器a的名称为________,装置A的圆底烧瓶中发生反应的化学方程式为________,为保持装置C为无水环境,装置B中加入的试剂是________。
(2)实验步骤:如图连接装置后,先________(填实验操作),再装药品,然后点燃________(填“A”或“C”)处酒精灯,当________(填实验现象)时,再点燃________(填“A”或“C”)处酒精灯。
(3)装置D的作用是________,________。
(4)甲同学认为进入装置C的气体中混有HCl,应在装置B前增加装有________(填试剂名称)的洗气装置除去;乙同学认为不需要除去HCl,理由为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中有一瓶含有一定量杂质的烧碱样品,某学生用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,请根据实验回答:
(1)将准确称取的4.3g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、托盘天平外,还必须用到的仪器有:、 .
(2)取10.00mL待测液,选择下图中(填A或B)来移取.![]()
(3)用0.2000标准盐酸滴定待测烧碱溶液,以酚酞为指示剂.滴定时左手旋转滴定管玻璃活塞,右手不停地摇动锥形瓶,两眼注视 , 直到滴定终点.滴定达到终点的标志是: .
(4)根据下列数据,烧碱的纯度为:(精确到小数点后一位)
滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
(5)判断下列操作引起的误差(填“偏大”、“偏小”或“无影响”)①滴定前读数正确,滴定终点读数时仰视. .
②未用标准液润洗滴定管. .
③滴定终点时发现滴定管尖嘴处悬挂着一滴溶液. .
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上将Na2CO3和Na2S配成溶液,再通入SO2可制取Na2S2O3,同时放出CO2。下列说法不正确的是( )
A. 上述反应中氧化剂和还原剂的物质的量比是2:l
B. 上述反应中的Na2CO3和Na2S的物质的量比最佳是1:2
C. 每生成lmol Na2S2O3转移4mol电子
D. Na2S2O3既是氧化产物,又是还原产物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com