
科目: 来源: 题型:
【题目】A、B、C、D、E、F是六种短周期的主族元素,原子序数依次增大,A是IA族的非金属元素,B元素的最高价氧化物的水化物与其简单气态氢化物可反应生成盐,C是短周期中原子半径最大的元素,D元素原子L层电子数和M层电子数之差等于B元素最外层电子数,E元素最高正价和最低负价代数和等于4,据此回答下列问题:
(1)F元素在周期表中的位置__________,C原子结构示意图______________。
(2)A、B两元素可形成18电子的分子,该分子的电子式为_______________。
(3)A和氧元素形成的简单化合物,其熔沸点高于A和E形成的简单化合物,原因是____________。
(4)C、D、F可形成复杂化合物C[DF4],该化合物含有的化学键类型为________________。
(5)仅有上述元素形成的化合物或单质间的某些反应,可用以说明E和F两元素非金属性的强弱,写出其中一个离子反应方程式__________________________________。
(6)写出C、D两元素最高价氧化物的水化物反应的离子方程式____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳是一种常见的元素,它以多种形式广泛存在于自然界之中。
(1)星际空间存在多种有机分子和无机分子,多数都含有碳元素,C2是一种星际分子,C2和C60互为_______________。
(2)CO2是碳元素重要的氧化物,回答下列有关问题:
①利用CO2与Na2O2反应,可向呼吸面具中提供氧气,其反应方程式为_________________。
②工业上可由CO2和NH3在一定条件下合成尿素,反应方程式为2NH3+CO2![]() CO(NH2)2+H2O当
CO(NH2)2+H2O当![]() 时,CO2的转化率随时间的变化关系如图所示.
时,CO2的转化率随时间的变化关系如图所示.
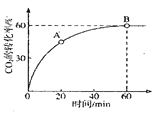
A点的逆反应速率![]() __________B点的正反应速率
__________B点的正反应速率![]() (填“大于“小于”或“等于”),NH3的平衡转化率为____________。
(填“大于“小于”或“等于”),NH3的平衡转化率为____________。
③随着对环境问题认识的深入,CO2的转化捕获问题已成为科研热点之一,以附着纳米银的惰性电极作阴极,可电解CO2转化为CO,装置示意图如下:
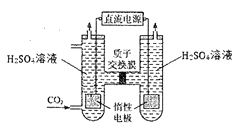
写出通CO2侧电极反应式_________________。
④CO2可用于生产碳酸饮料。苯甲酸钠(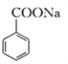 可写为C6H5COONa)也是某些饮料的添加剂,具有抑菌防腐的作用。研究表明苯甲酸(C6H5COOH)的抑菌能力显著高于苯甲酸钠。在生产的某饮料的过程中,除了添加苯甲酸钠外,还需加压充入CO2气体。若忽略碳酸的二级电离,试写出碳酸与苯甲酸钠反应的离子方程式__________________,经计算该反应的化学平衡常数为______________,加压充入CO2后,该饮料的抑菌能力明显增强,结合上述离子方程式分析其原因_______________(已知:H2CO3的Ka1=4.17×10-7;C6H5COOH的Ka=6.25×10-5。)。
可写为C6H5COONa)也是某些饮料的添加剂,具有抑菌防腐的作用。研究表明苯甲酸(C6H5COOH)的抑菌能力显著高于苯甲酸钠。在生产的某饮料的过程中,除了添加苯甲酸钠外,还需加压充入CO2气体。若忽略碳酸的二级电离,试写出碳酸与苯甲酸钠反应的离子方程式__________________,经计算该反应的化学平衡常数为______________,加压充入CO2后,该饮料的抑菌能力明显增强,结合上述离子方程式分析其原因_______________(已知:H2CO3的Ka1=4.17×10-7;C6H5COOH的Ka=6.25×10-5。)。
查看答案和解析>>
科目: 来源: 题型:
【题目】按照要求写出下列反应方程式:
(1)硅酸钠的水溶液俗称水玻璃,向其中通入过量的CO2,会出现软而透明的凝胶胶体,其离子方程式是__;
(2)实验室通常用MnO2与浓盐酸反应制取氯气,其反应的离子方程式是__;如有1molCl2生成,被氧化的HCl的物质的量是__mol,转移电子的物质的量是__mol;
(3)铝和氢氧化钡溶液反应生成偏铝酸钡,反应的化学方程式为__;
查看答案和解析>>
科目: 来源: 题型:
【题目】氢硫酸在空气中有如此反应:2H2S+O2==2S↓+2 H2O,下列不正确的是( )
A.属于置换反应 B.还原性:H2O> H2S
C.氧化性:O2> S D.酸性:H2S> H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】Mg-AgCl电池是一种能被海水激活的一次性贮备电池,电池反应方程式为2AgCl+Mg= Mg2++2Ag+2Cl-,有关该电池说法错误的是
A.镁为电池负极B.有24g镁被氧化时,还原得到216g银
C.正极反应为Ag++e-=AgD.可用于海上应急照明
查看答案和解析>>
科目: 来源: 题型:
【题目】在KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O反应中,
(1)氧化剂是__,氧化产物是__.
(2)写出该反应的离子方程式.__.
(3)若有219gHCl参加反应,产生Cl2的体积(标况下)为__ L,转移电子__ mol.
(4)Cl2有毒,多余的Cl2通常用氢氧化钠溶液吸收,反应的离子方程式为:__.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应既是氧化还原反应,又是吸热反应的是( )
A.铝片与稀硫酸的反应B.Ba(OH)2·8H2O与NH4Cl的反应
C.灼热的碳与二氧化碳的反应D.甲烷在氧气中的燃烧反应
查看答案和解析>>
科目: 来源: 题型:
【题目】T K时,向2.0L恒容密闭容器中充入0.10molCOCl2,发生反应![]() ,经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是
,经过一段时间后反应达到平衡。反应过程中测得的部分数据见下表,下列说法正确的是

A. T K时该反应的化学平衡常数为![]()
B. 反应在前2s的平均速率![]() mol·L-1·s-1
mol·L-1·s-1
C. 保持其他条件不变,升高温度,若新平衡时c(C12)=0.038mol·L-1,则反应的△H<0
D. 平衡后向上述容器中再充入0.10molCOCl2,平衡正向移动,COCl2的转化率增大
查看答案和解析>>
科目: 来源: 题型:
【题目】一种突破传统电池设计理念的镁—锑液态金属储能电池工作原理如下图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。该电池工作一段时间后,可由太阳能电池充电。下列说法不正确的是
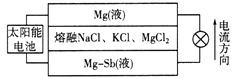
A. 放电时,Mg(液)层的质量减小
B. 放电时正极反应为:Mg2++2e—=Mg
C. 该电池充电时,Mg—Sb(液)层发生还原反应
D. 该电池充电时,C1—向中层和下层分界面处移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com