
科目: 来源: 题型:
【题目】分类是化学研究的重要方法,下列物质分类错误的是()
A.化合物:干冰、明矾、烧碱B.同位素:石墨、C60、金刚石
C.混合物:漂白粉、纯净矿泉水、盐酸D.非电解质:乙醇、四氯化碳、甲烷
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有机物检验方法正确的是( )
A.取少量卤代烃加NaOH水溶液共热,冷却,再加AgNO3溶液检验卤原子存在
B.苯和乙烯都能使溴水褪色,但褪色的原理是不同的
C.用溴水可以鉴别乙烯与乙炔
D.苯和苯的同系物都可以用酸性高锰酸钾溶液鉴别
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应属于取代反应的是
A.乙醇在空气中燃烧
B.光照条件下,甲烷与氯气发生反应
C.乙烯使溴的四氯化碳溶液褪色
D.在镍做催化剂的条件下,苯与氢气发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】G是一种常见的氨基酸,其合成路线如图:
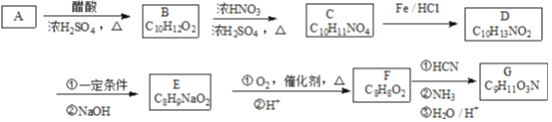
已知以下信息:
①A苯环上只有1个取代基且核磁共振氢谱有6组峰,其面积之比为1:2:2:2:2:1;D和F的苯环上的一氯代物都只有2种;
②F、G能与FeCl3溶液发生显色反应,F能发生银镜反应;
③ 。
。
回答下列问题:
(1)B的名称为____________。
(2)F→G的过程中①的反应类型是____________。
(3)B→C 反应的化学方程式为____________。
(4)G的结构简式为____________。
(5)F含有苯环且能发生水解反应的同分异构体有____种,其中核磁共振氢谱有4組峰,且面积之比为3:2:2:1的是____________。
(6)参照本题中的合成路线,请以乙烯为原料,合成丙氨酸(![]() );写出合成路线的流程图(无机试剂可任选) ________。合成流程图示例如下:
);写出合成路线的流程图(无机试剂可任选) ________。合成流程图示例如下:![]() 。
。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A、B、C、D、E、F是周期表前四周期的元素,原子序數依次增大。A的基态原子2p能级上有2个单电子;C是地壳中含量最多的元素;E的单质常温常压下为黄绿色气体,化学性质十分活泼,具有毒性;F位于ds区,最外能层有单电子,是热和电最佳导体之一;D与F不同周期,但最外能层电子数相等。
(1)写出基态C原子的电子排布式: ____________。
(2)A、B、C三种元素第一电离能最大的是____________。(用元素符号表示),其原因是____________。
(3)B、C两元素形成的化合物B2C的分子空间构型为____________。与B2C互为等电子体的粒子的化学式为____________。(填一种)。
(4)D、E形成的一种离子化合物,在晶胞结构图中黑球表示E的位置,白球表示D的位置,已知该晶胞的边长为ncm,阿伏加德罗常数为NA,求晶胞的密度ρ=_______g/cm3(用含n、NA的计算式表示)。
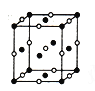
(5)由F原子形成的晶胞结构如图,F原子的半径为r,列式表示F原子在晶胞中的空间利用率:__________________(不要求计算结果)。
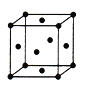
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯醇的结构简式为CH2=CH-CH2OH,它可以发生的反应有:①取代;②加成;③加聚;④氧化;⑤燃烧,其中正确的是
A.只有①②⑤B.只有②③C.除④外D.全部
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2) 提取铜的操作流程如图:。
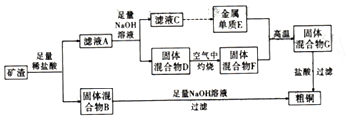
已知:Cu2O+2H+=Cu+Cu2++H2O。
(1)铁在元素周期表中的位置为___________;固体混合物B与氢氧化钠溶液反应的离子方程式为___________________。
(2)滤液A中铁元素的存在的离子形式为_______,.理由是_____________(用离子方程式表达,不必书写Cu2O 与盐酸的反应)。
(3)将滤液C中的铝元素以沉淀形式析出,可选用多种试剂,请写出用最佳方案反应的离子方程式:_______________。
(4)工业上利用电解法进行粗铜精炼时,下列叙述正确的是______ (填序号)。
a.电解过程中,阳极质量的减轻量一定等于阴极质量的增加量
b.粗铜接电源正极,发生氧化反应
c.电解过程中,粗铜中所有杂质均被氧化
d.电解精炼过程中可以用硝酸银溶液作电解质溶液
(5)取320g固体混合物F 于硬质玻璃管中,通入足量氢气充分加热还原,固体质量减轻80g,若将所得的还原产物与足量稀盐酸反应,产生的H2在标准状况的体积为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学兴趣小组用100mL 1mol/L NaOH溶液完全吸收了a mol CO2后得到溶液A(液体体积无变化).为了确定溶液A的溶质成分及a值,该兴趣小组的同学进行了如下实验.请帮助他们完成下列相应实验内容.
(1)[提出假设] 假设Ⅰ:溶液A的溶质为NaOH、Na2CO3;
假设Ⅱ:溶液A的溶质为Na2CO3;
假设Ⅲ:溶液A的溶质为Na2CO3、NaHCO3;
假设Ⅳ:溶液A的溶质为 .
(2)[实验过程] (i)甲同学取少量溶液A于试管,再向试管中滴加几滴酚酞溶液,溶液A变红,由此得出假设I成立.
(ii)乙同学分析后认为甲同学的实验结论有误.请用离子方程式说明乙同学的判断依据;他进一步提出,应先取少量溶液,向其中加入足量的溶液,来检验溶液A是否含 , 结果加入检验溶液后观察到溶液A变浑浊.
(iii)丙同学为了检验溶液A是否还含其它溶质,他将乙同学所得浑浊溶液进行过滤,并把滤液分为两份,向其中的一份加入稀硫酸,有无色气体生成,则假设正确.
(iv)为准确测定a值,丁同学取了10mL 溶液A在锥形瓶中,用滴定管向其中加入某浓度的稀硫酸,记录加入硫酸的体积与生成气体的情况,并绘制成如图:则a= , 所加硫酸的物质的量浓度为 . 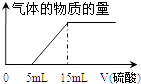
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知: 2SO2(g)+O2(g)![]() 2SO3(g) △H=-XkJ/mol;
2SO3(g) △H=-XkJ/mol;
2NO(g)+O2(g)![]() 2NO2(g) △H=-YkJ/mol。
2NO2(g) △H=-YkJ/mol。
则反应NO(g)+SO2(g)![]() SO3(g)+NO(g) 的△H=______ kJ/mol。
SO3(g)+NO(g) 的△H=______ kJ/mol。
(2)甲烷是一种高效清洁的新能源,0.25mol甲烷完全燃烧生成液态水时放出热量222.5kJ,则甲烷燃烧的热化学方程式为____________。
(3)以KOH溶液为电解质溶液,依据(2)中反应设计一个原电池,其负极反应式为_______;以H2SO4溶液为电解质溶液,将甲烷燃料电池中的甲烷改为C2H5OH,其负极反应式为_________。
(4)以上述甲烷燃料电池为电源,用铂电极电解1LCu(NO3)2和KNO3混合溶液,通电一段时间,两极均产生11.2L(标准状况)气体。则电解后溶液的pH为______(电解过程中溶液体积不变),原混合溶液中Cu2+的物质的量浓度为___________,假设电解过程中能量利用率为80%,在甲烷燃料电池中消耗的甲烷在标准状况下的体积为________L。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 在O2参与的反应中,1molO2作氧化剂时得到的电子数一定是4NA
B. 25℃、1.01×105Pa条件下,11.2L丙炔分子中所含碳氢键数为2NA
C. 常温下,2.7g铝分别与足量的盐酸或烧碱溶液反应时,失去的电子数都为0.3NA
D. 1molNO2与足量H20反应,转移的电子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com