
科目: 来源: 题型:
【题目】一定条件下经不同的化学反应,可以实现图示变化,A为酸式盐;B为无色无味气体;无色气体D可使红色石蕊试纸变蓝;X、F和Y为气体单质,且Y为有色气体,F为空气的主要成分之一;G为正盐,G和无色气体M在溶液中可反应生成B,反应⑤是常见工业原理. 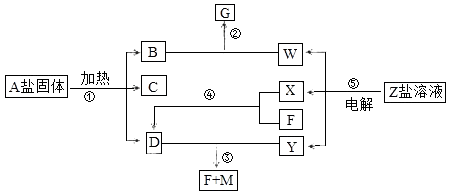
(1)写出下列物质的化学式:A;Y
(2)写出反应②的离子方程式 .
(3)写出反应③的化学方程式 .
(4)常温下pH=10,体积均为100mL的D、W两溶液与M反应,消耗的M的物质的量关系DW(填“大于”“小于”或“等于”).
查看答案和解析>>
科目: 来源: 题型:
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、S02等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知: ①NO2+CO![]() CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
CO2+NO该反应的平衡常数为K1(下同),每1mol下列物质分解为气态基态原子吸收的能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) △H=+179.5kJ/mol K2
2NO(g) △H=+179.5kJ/mol K2
③2NO(g)+O2(g)![]() 2NO2(g) △H=-112.3kJ/mol K3
2NO2(g) △H=-112.3kJ/mol K3
写出NO与CO反应生成无污染气体的热化学方程式____________________________________,该热化学方程式的平衡常数K=_________(用K1、K2、K3表示)。
(2)在体积可变的恒压(p总)密闭容器中充入1molCO2 与足量的碳,让其发生反应: C(s)+ CO2(g)![]() 2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
2CO(g) △H>0。平衡时,体系中气体体积分数与温度的关系如下图所示。
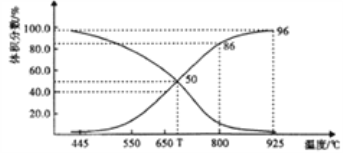
①T℃时,在容器中若充入稀有气体,v(正)___v(逆)(填“>”“<”或“="),平衡______移动(填“正向”“逆向”或“不”。下同);若充入等体积的CO2 和CO,平衡________移动。
②CO体积分数为40%时,CO2 的转化率为_______。
③已知:气体分压(p分)=气体总压×体积分数。用平衡分压代替平衡浓度表示平衡Kp常数的表达式为__________;925℃时,Kp=______(用含p总的代数式表示)。
(3)直接排放含SO2 的烟气会形成酸雨,危害环境。可用NaOH吸收,所得含硫各微粒(H2SO3、HSO3-和SO32-)存在于反应后的溶液中,它们的物质的量分数X(i)与溶液pH的关系如图所示。

①若是0.1mol/LNaOH 反应后的溶液,测得溶液的pH=8时,溶液中各离子浓度由大到小的顺序是______________。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2 溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】能源与人类的生活和社会发展密切相关,下列关于能源开发和利用的说法中,你认为说法不正确的是
A. 充分利用太阳能
B. 因地制宜开发利用风能、水能、地热能、潮汐能
C. 合理、安全开发利用氢能、核能
D. 能源都是通过化学反应获得的
查看答案和解析>>
科目: 来源: 题型:
【题目】下列选项正确的是
A. 25℃时,AgBr在0.01mol/L的MgBr2溶液和NaBr溶液中的溶解度相同
B. NaCN溶液和盐酸混合呈中性的溶液中:c(Na+)>c(Cl-)=c(HCN)
C. 25℃时,将0.01mol/L的醋酸溶液加水不断稀释,  减小
减小
D. Na2CO3、NaHCO3溶液等浓度等体积混合后: 3c(Na+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
查看答案和解析>>
科目: 来源: 题型:
【题目】以SO2为原料,通过下列工艺可制备化工原料H2SO4和清洁能源H2。下列说法中不正确的是

A. 该生产工艺中Br2被循环利用
B. 在电解过程中,电解槽阴极附近溶液的pH变大
C. 原电池中负极发生的反应为SO2+2H2O-2e-=SO42-+4H+
D. 该工艺总反应的化学方程式表示为SO2+Br2+2H20=2HBr+H2SO4
查看答案和解析>>
科目: 来源: 题型:
【题目】铝热反应是铝的一个重要性质,该性质用途十分广泛.“铝热反应”的现象有这样的描述:“反应放出大量的热,并发出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”.已知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如表:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 | - |
I.(1)某同学推测,铝热反应所得到的熔融物应是铁铝合金.理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金.你认为他的解释是否合理? ______ (填“合理”或“不合理”).
(2)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,反应的离子方程式为 ______ .
(3)实验室溶解该熔融物,在下列试剂中最适宜的试剂是 ______ (填序号).
A、浓硫酸B、稀硫酸 C、稀硝酸D、氢氧化钠溶液
Ⅱ.实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出.在反应结束后的溶液中,逐滴加入6molL-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.试回答下列问题:
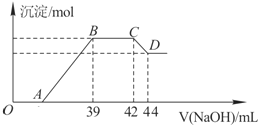
(1)依题意,请写出熔融物中铁与该稀的硝酸反应的离子方程式: ______
(2)在BC段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为 ______ ;
(3)熔融物中铝元素的物质的量为 ______ mol.
(4)B点对应的沉淀的物质的量为 ______ mol,A点对应的氢氧化钠溶液的体积为 ______ mL.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关于氯及其化合物的说法不正确的是
A. 干燥的氯气可以使鲜花褪色
B. 氢气在氯气中安静地燃烧,发出黄色火焰,生成物溶于水可制得盐酸
C. 漂白粉的主要成分为CaCl2和Ca(ClO)2,有效成分为后者
D. 新制氯水中含有HClO,具有漂白性
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
A.950 mL 111.2 g
B.500 mL 117 g
C.1 000 mL 117 g
D.任意规格 111.2 g
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法不正确的是( )
A. 氯化钠可用于配制生理盐水 B. 二氧化硅可用于制造玻璃
C. 海水中的钠元素以单质存在 D. 氧化镁(熔点2 800 ℃)是优良的耐高温材料
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com