
科目: 来源: 题型:
【题目】汽车内燃机工作时产生的电火花和高温会引起反应:N2(g)+O2(g)═2NO(g),导致汽车尾气中的NO和NO2对大气造成污染.
(1)在不同温度(T1 , T2)下,一定量的NO分解产生N2和O2的过程中N2的体积分数随时间t变化如图1所示.根据图像判断反应N2(g)+O2(g)═2NO(g)为反应(填“吸热”或“放热”),随着温度的升高,该反应的平衡常数K(填“增大”“减小”或“不变”,平衡向移动(填“向左”“向右”或“不”). 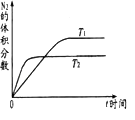
(2)某温度时,向容积为1L的密闭容器中充入5mol N2与2.5mol O2 , 发生N2(g)+O2(g)═2NO(g)反应,2min后达到平衡状态,NO的物质的量为1mol,则2min内氧气的平均反应速率为 , 该温度下,反应的平衡常数K= . 该温度下,若开始时向上述容器中加入的N2与O2均为1mol,则N2的平衡浓度为mol/L.
(3)为避免汽车尾气中的有害气体对大气的污染,给汽车安装尾气净化装置.净化装置里装有含Pd等过渡元素的催化剂,气体在催化剂表面吸附与解吸作用的机理如图2所示.写出上述变化中的总化学反应方程式: . 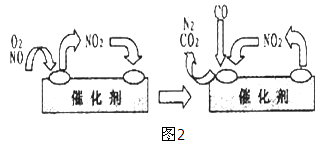
(4)用CH4催化还原NO2的方法也可以消除氮氧化物的污染.例如: CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ/mol
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ/mol
写出CH4还原NO2至N2的热化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列解释事实的化学方程式或离子方程式,正确的是( )
A. 已知酸性:H2CO3>HClO>![]() ,NaClO溶液中通入少量CO2:2ClO-+H2O+CO2=2HClO+
,NaClO溶液中通入少量CO2:2ClO-+H2O+CO2=2HClO+![]()
B. 碳酸氢钙溶液与少量氢氧化钠溶液混合出现白色沉淀: ![]() +Ca2++OH-=CaCO3↓+H2O
+Ca2++OH-=CaCO3↓+H2O
C. 向硫酸氢钠溶液中滴加氢氧化钡溶液至![]() 沉淀完全:Ba2++2OH-+2H++
沉淀完全:Ba2++2OH-+2H++![]() =BaSO4↓+2H2O
=BaSO4↓+2H2O
D. 自然界中正常的雨水呈酸性:H2O+CO2![]() H2CO3
H2CO3![]() 2H++
2H++![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】在不同温度下,向2L密闭容器中加入1mol NO和1mol活性炭,发生反应:
2NO(g)+C(s) ![]() N2(g)+CO2(g) ΔH=-213.5kJ/mol,达到平衡时的数据如下:
N2(g)+CO2(g) ΔH=-213.5kJ/mol,达到平衡时的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | X | |
T2 | 0.25 |
下列说法不正确的是( )
A. T2℃时,若该反应经过10min达到平衡,反应速率v(NO)=0.025mol/(L·min)
B. T1℃时,若该反应的平衡常数K=9/16,则达平衡时NO的转化率为60%
C. T2℃时,若反应达平衡后再缩小容器的体积,c(N2):c(NO)不变
D. T1℃时,若开始时反应物的用量均减少一半,平衡后NO的转化率减小
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素的核内质子数之和为56,在元素周期表中的位置如图所示,1 mol E的单质可与足量酸反应,能产生33.6 L H2(在标准状况下);E的阳离子与A的阴离子核外电子层结构相同。
A | ||
B | C | D |
回答下列问题:
(1)写出下列元素名称A__________,B___________,E____________
(2)C的简单离子结构示意图为_____________
(3)B单质在A单质中燃烧,反应现象是__________________________________,生成物的化学式为___________
(4)A与E形成的化合物的化学式为__________,它的性质决定了它在物质的分类中应属于__________________
(5)向D与E形成的化合物的水溶液中滴入烧碱溶液至过量,此过程中观察到的现象是_______________________,写出有关化学反应方程式______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是比较过氧化钠和氧化钠性质异同的有关叙述,其中错误的是( )
A. 过氧化钠和氧化钠长期置于空气中最终产物相同
B. 过氧化钠和氧化钠都能与二氧化碳或水发生化合反应
C. 过氧化钠和氧化钠与水反应都有氢氧化钠生成
D. 过氧化钠是强氧化剂,而氧化钠是一种碱性氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学反应中,是氧化还原反应的是( )
A. 2NaOH+H2SO4===Na2SO4+2H2O
B. FeO+H2SO4===FeSO4+H2O
C. BaCl2+H2SO4===BaSO4↓+2HCl
D. H2+CuO===Cu+H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学兴趣小组为制备消毒液(主要成分是NaClO),设计了下列装置,并查阅到下列资料:在加热情况下氯气和碱溶液能发生如下反应:3Cl2+6OH﹣ ![]() 5Cl﹣+ClO3﹣+3H2O,请回答下列问题:
5Cl﹣+ClO3﹣+3H2O,请回答下列问题: 
(1)连接好装置,装药品之前,必须进行的一项操作步骤是 .
(2)圆底烧瓶内发生反应的化学方程式为;大试管内发生反应的离子方程式为 .
(3)饱和食盐水的作用是;冰水的作用是 .
(4)在制取Cl2时,实验室中若无MnO2 , 可用KMnO4粉末代替,发生下列反应:2KMnO4+16HCl(浓)═2MnCl2+2KCl+5Cl2↑+8H2O,则可选择的发生装置是(填序号) .
查看答案和解析>>
科目: 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A. 由①中的红棕色气体,推断产生的气体一定是混合气体
B. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目: 来源: 题型:
【题目】在4L密闭容器中充入6molA气体和5molB气体,一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol/L,下列判断正确的是
2C(g)+xD(g),达到平衡时,生成了2molC,经测定,D的浓度为0.5mol/L,下列判断正确的是
A. B的转化率为20%
B. 平衡时A的浓度为1.50mol/L
C. x=1
D. 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列短周期元素的数据(已知Be的原子半径为0.089 nm):
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径 (nm) | 0.074 | 0.160 | 0.152 | 0.110 | 0.099 | 0.186 | 0.075 | 0.082 |
最高正化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
最低负化合价 | 2 | 3 | 1 | 3 |
(1)⑧号元素的在周期表中的位置是________________;上述元素处于同一主族的有_________________________。(用元素符号表示!)
(2)上表中某两种元素形成的共价化合物中,每个原子都满足最外层为8电子的稳定结构,写出其电子式:__________________________(任写一种
(3)元素①和⑥能形成两种化合物,写出其中较稳定的化合物与水反应的离子方程式_____________________________________________________。
(4)含锂材料在社会中广泛应用,如各种储氢材料(Li2NH等)、便携式电源材料(LiCoO2等)。根据下列要求回答问题:
①![]() 和
和![]() 作核反应堆最佳热载体,
作核反应堆最佳热载体,![]() 和
和![]() 用作高温堆减速剂。下列说法正确的是________
用作高温堆减速剂。下列说法正确的是________
A. ![]() 和
和![]() 互为同位素 B.
互为同位素 B. ![]() 和
和![]() 属于同种核素
属于同种核素
C. ![]() 和
和![]() 的化学性质不同 D.
的化学性质不同 D. ![]() 和
和![]() 是同种物质
是同种物质
②下列说法不正确的是_________
A. 碱性:Be(OH)2 < LiOH < NaOH < KOH
B. 半径:K > Na > Li > Li+
C. 氧化性:Li+ < Na+ < K+ < Rb+ < Cs+
D. 金属性:Cs > Rb > K > Na > Li > Be
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com