
科目: 来源: 题型:

| ||
| ||
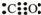
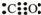
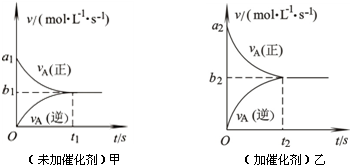
 F (g)+D (g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)
F (g)+D (g)反应速率和时间的关系如图2所示,那么在t1时速率发生改变的原因可能是(填选项字母)查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
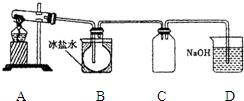 室验室制N2O4需用NO2时,可用无水硝酸盐加热分解获得.已知硝酸盐分解时NO3-完全转化为NO2,现有硝酸盐:a Cu (NO3)2、b Mn (NO3)2、c Hg (NO3)2,若利用加热分解方法制NO2,已知它们分解后的固体生成物为CuO、MnO2、Hg等,并按以下装置(如图所示)制取N2O4;
室验室制N2O4需用NO2时,可用无水硝酸盐加热分解获得.已知硝酸盐分解时NO3-完全转化为NO2,现有硝酸盐:a Cu (NO3)2、b Mn (NO3)2、c Hg (NO3)2,若利用加热分解方法制NO2,已知它们分解后的固体生成物为CuO、MnO2、Hg等,并按以下装置(如图所示)制取N2O4;
| ||
| ||
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
科目: 来源: 题型:
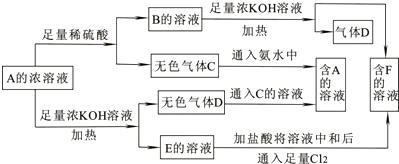
查看答案和解析>>
科目: 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com