
科目: 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时,存在以下反应:
①N2(g)+O2(g) ![]() 2NO(g) △H1=+183 kJ·mol-1
2NO(g) △H1=+183 kJ·mol-1
②2H2(g)+O2(g)=2H2O(1) △H2=-571. 6 kJ·mol-1
③4NH3(g)+5O2(g) =4NO(g)+6H2O(1) △H3=-1164.4 kJ·mol-1
则合成氨的反应N2(g)+3H2(g)![]() 2NH3(g) △H=____________kJ·mol-1。
2NH3(g) △H=____________kJ·mol-1。
(2)在恒温恒容容积为1 L的密闭容器中进行合成氨的反应,起始加入N2:1.0 mol、H2:3.0 mol。
①该温度下合成氨反应的平衡常数表达式为__________________。
②若其它条件不变增大压强,则合成氨反应的化学平衡常数_____________(填“变大”、“变小”或“不变”);
③经过2min达到化学平衡状态时测得H2的浓度为1.8mol/L,则平均化学反应速率v(NH3)_____________,氢气的转化率为________________。
④下图表示合成氨反应中H2 (g)的平衡转化率随温度的变化关系,判断P1_____P2(填“>”“ <”或“ = ”),并简述理由:__________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】氧元素有三种核素16O、17O、18O,它们在自然界中所占的原子个数百分比分别为a%、b%、c%,则下列说法正确的是( )
A.一个16O原子的质量为16g
B.17O的相对原子质量约为17
C.氧元素的相对原子质量为 ![]()
D.氧元素的相对原子质量为(16a%+17b%+18c%)
查看答案和解析>>
科目: 来源: 题型:
【题目】现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,A、D同主族,C与E同主族,D、E、F同周期,A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C形成电子总数相等的分子,且A与C形成的化合物常温下为液态,A能分别与E、F形成电子总数相等的气体分子。
请回答下列问题.(题中的字母只代表元素代号,与实际元素符号无关):
(1)B的元素符号为_________,E元素在周期表中位于第____周期_____族;
(2)A、C、D三种元素组成的一种常见化合物,是氯碱工业的重要的产品,请写出该反应的化学方程式___________。
(3)A2C和A2E两种物质沸点较高的是_______(填写化学式),原因是:_______。
(4)B与F两种元素形成的一种化合物分子,各原子均达8电子结构,则该化合物化学式为____。B和F两种元素还能形成另一种化合物,其中B显最高正价,该化合物能与水反应生成两种酸,请写出该化合物与水反应的化学方程式:____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行氯气的性质实验.玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是( )
① | ② | ③ | ④ | |
A | 黄绿色 | 橙色 | 蓝色 | 白色 |
B | 无色 | 橙色 | 紫色 | 白色 |
C | 黄绿色 | 橙色 | 蓝色 | 无色 |
D | 黄绿色 | 无色 | 紫色 | 白色 |
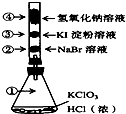
A.A
B.B
C.C
D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中的两种物质作用时,反应条件或反应物的用量改变时,对生成物没有影响的是
A. Na与O2 B. Na2O2与CO2 C. C与O2 D. NaOH与CO2
查看答案和解析>>
科目: 来源: 题型:
【题目】对危险化学品要在包装标签上印有警示性标志。下列化学药品名称与警示标志名称对应正确的是( )
A.浓硫酸——腐蚀品B.酒精——剧毒品
C.汽油——爆炸品D.烧碱——剧毒品
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu2SO3·CuSO3·2H2O是一种深红色固体(以下用M表示)。某学习小组拟测定胆矾样品的纯度,并以其为原料制备M。
已知:①M不溶于水和乙醇,100℃时发生分解反应;
②M可由胆矾和SO2为原料制备,反应原理为3Cu2++6H2O+3SO2![]() Cu2SO3·CuSO3·2H2O↓+8H++SO42-。
Cu2SO3·CuSO3·2H2O↓+8H++SO42-。
I.测定胆矾样品的纯度。
(1)取w g胆矾样品溶于蒸馏水配制成250mL溶液,从中取25.00mL于锥形瓶中,加入指示剂,用c mol·L-1EDTA(简写成Na4Y)标准溶液滴定至终点(滴定原理:Cu2++Y4-====CuY2-),测得消耗了V mL EDTA标准溶液。则该胆矾样品的纯度为____________%(用含c、V、w的代数式表示)。如果滴定管装液前没有用EDTA标准溶液润洗,测得的结果会_________ (填“偏高”“偏低”或“无影响”)。
Ⅱ.制备M。实验装置如下图所示:
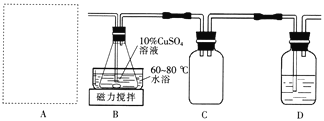
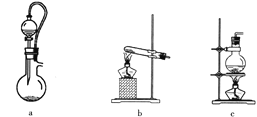
(2)实验室用70%硫酸与亚硫酸钠粉末在常温下制备SO2。上图A处的气体发生装置可从下图装置中选择,最合适的是________(填字母)。
(3)装置D中的试剂是____________。装置B中水浴加热的优点是____________________。
(4)实验完毕冷却至室温后,从锥形瓶中分离产品的操作包括:__________、水洗、乙醇洗、常温干燥,得产品Cu2SO3·CuSO3·2H2O。检验产品已水洗完全的操作是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.近年来甲醇用途日益广泛,越来越引起商家的关注,工业上甲醇的合成途径多种多样。现有实验室中模拟甲醇合成反应,在2 L 密闭容器内,400 ℃时反应:CO(g)+2H(g) ![]() CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
CH3OH(g) △H<0,体系中n(CO)随时间的变化如表:
时间(s) | 0 | 1 | 2 | 3 | 5 |
n(CO)(mol) | 0.020 | 0.011 | 0.008 | 0.007 | 0.007 |
(1)图中表示CH3OH 的变化的曲线是_______。

(2)用H2 表示从0~2s 内该反应的平均速率v(H2)=______。
(3)能说明该反应已达到平衡状态的是______。
a.v(CH3OH)=2v(H2) b.容器内压强保持不变
c.2V 逆(CO)= v 正(H2) d.容器内密度保持不变
(4) CH3OH 与O2的反应可将化学能转化为电能,其工作原理如右图所示,图中CH3OH 从______(填A 或B)通入, b 极的电极反应式是______。
II.某研究性学习小组为探究锌与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验:
实验①: 把纯锌片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:

实验②: 把纯锌片投入到含FeCl3 的同浓度工业稀盐酸中,发现放出氢气的量减少。
实验③: 在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是_______________。 t2~t3速率变化的主要原因是______________。
(2)实验②放出氢气的量减少的原因是________。
(3)某同学认为实验③反应速率加快的主要原因是因为形成了原电池,你认为是否正确?_____ (填“正确”或“不正确”)。请选择下列相应的a或b作答。
a、若不正确,请说明原因:________________。
b、若正确则写出实验③中原电池的正极电极反应式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子,能大量共存于同一溶液中的是( )
A.CO32-、H+、Na+、NO3-B.H+、Ag+、Cl-、SO42-
C.K+、Na+、OH-、NO3-D.Ba2+、Ca2+、SO42-、OH-
查看答案和解析>>
科目: 来源: 题型:
【题目】20 mL浓度为0.05 mol/L-1的Na2SO3溶液恰好与20 mL浓度为0.02 mol/L的NaXO4溶液完全反应。溶液中XO4-被还原为较低价态,则X元素的化合价变为
A. +1 B. +2 C. +3 D. +4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com