
科目: 来源: 题型:
【题目】有甲、乙两位同学均想利用原电池反应检测金属的活动性顺序,两人均用镁片和铝片作电极,但甲同学将电极放入6molL﹣1的H2SO4溶液中,乙同学将电极放入6molL﹣1的NaOH溶液中,如图所示. 
(1)写出甲中正极的电极反应式 .
(2)乙中总反应的离子方程式: .
(3)如果甲与乙同学均认为“构成原电池的电极材料如果都是金属,则构成负极材料的金属应比构成正极材料的金属活泼”,则甲会判断出活动性更强,而乙会判断出活动性更强.(填写元素符号)
(4)由此实验得出的下列结论中,正确的有 . A.利用原电池反应判断金属活动性顺序时应注意选择合适的介质
B.镁的金属性不一定比铝的金属性强
C.该实验说明金属活动性顺序表已过时,没有实用价值了
D.该实验说明化学研究对象复杂、反应受条件影响较大,应具体问题具体分析.
查看答案和解析>>
科目: 来源: 题型:
【题目】呋喃甲酸是抗菌素一种,在食品工业中作防腐剂,也作涂料添加剂、医药、香料等中间体,可用呋喃甲醛制备,其实验原理和制备步骤如下:
![]()
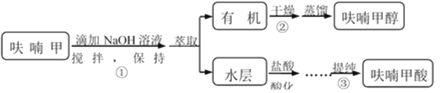
步骤③提纯过程:溶解→活性炭脱色→趁热过滤→冷却结晶→抽滤→洗涤→干燥。
已知:①呋喃甲酸在100℃升华,133℃熔融,230-232℃沸腾,并在此温度下脱羧;
②呋喃沸点为31-32℃,易溶于水;
③无水氯化钙能与醇形成复合物。
(1)步骤①的关键是控制温度,其措施有:磁力搅拌、______和______。
(2)步骤②中干燥所使用的干燥剂可选用______。
A.98%浓硫酸 B.无水硫酸镁
C.无水碳酸钠 D.无水氯化钙
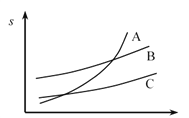
(3)呋喃甲酸在A、B、C三种溶剂中溶解度(s)随温度变化的曲线如图:步骤③提纯时,合适的溶解溶剂是______,其理由______。
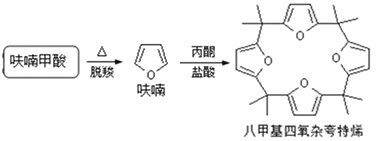
(4)利用呋喃甲酸可以制取八甲基四氧杂夸特烯。
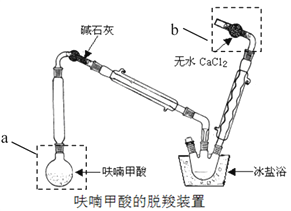
①仪器a的名称:______,装置b的作用:______,
②脱羧装置中用冰盐浴的目的是______;
③确定产品为八甲基四氧杂夸特烯,可通过测定沸点,还可采用的检测方法有______。
④若用4.5g呋喃甲酸制得了0.5g八甲基四氧杂夸特烯(M=432g·mol-1),则产率为______(保留4位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据元素周期表和元素周期律,下列叙述正确的有几项

①气态氢化物的稳定性:H2O>NH3>SiH4;②氢元素与其他元素可形成共价化合物或离子化合物;③图1所示实验可证明元素的非金属性:Cl>C>Si;④用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
A. 1项 B. 2项 C. 3项 D. 4项
查看答案和解析>>
科目: 来源: 题型:
【题目】由铜片、锌片和200 mL 稀H2SO4组成的原电池中,若锌片只发生电化学反应,则当铜片上共放出3.36 L(标准状况)气体时,H2SO4恰好完全消耗。求:
(1)反应中消耗的锌的质量是多少______?
(2)有多少个电子通过了导线______?
(3)原稀H2SO4的物质的量浓度是多少______?
查看答案和解析>>
科目: 来源: 题型:
【题目】收藏的清末铝制艺术品至今保存完好,该艺术品未被锈蚀的主要原因是( )
A.铝不易被氧化
B.铝的氧化物在空气中易变成铝
C.铝不易发生化学反应
D.铝易氧化,形成的氧化膜有保护作用
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究元素周期律。
甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图1装置来一次性完成同主族元素C和Si的非金属性强弱比较的实验研究;
乙同学设计了如图2装置来验证卤族元素性质的递变规律,图2中A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。
已知常温下浓盐酸与高锰酸钾能反应生成氯气。

(1)从以下所给物质中选出甲同学设计的实验所用到物质:图1中试剂A、B为(填序号)____;
①稀硫酸溶液; ②浓盐酸; ③碳酸钠粉末;④Na2SO3溶液
写出图1烧瓶中发生反应的离子方程式为__________________________________________;
(2)甲同学所做实验图1烧杯中现象为____________________________________;
(3)乙同学所做实验图2中B处的现象为__________________________________;
(4)写出图2中A处发生反应的离子方程式为__________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中滴加酚酞 | |
ii. 连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验i中的现象是______。
②用电极反应式解释实验i中的现象:______。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是______。
②进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 试管 | 现象 |
| 0.5 mol·L-1 K3[Fe(CN)6]溶液 | iii. 蒸馏水 | 无明显变化 |
iv. 1.0 mol·L-1NaCl 溶液 | 铁片表面产生大量蓝色沉淀 | ||
v. 0.5 mol·L-1Na2SO4溶液 | 无明显变化 |
a. 以上实验表明:在有______存在条件下,K3[Fe(CN)6]溶液可以与铁片发生反应。
b. 为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是______。
(3)有同学认为上述实验仍不够严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是______(填字母序号)。
实验 | 试剂 | 现象 |
A | 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
B | 酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
C | 铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
D | 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
(4)综合以上实验分析,利用实验ii中试剂能证实铁发生了电化学腐蚀的实验方案是:连好装置一段时间后,取铁片(负极)附近溶液于试管中,_____(回答相关操作、现象),则说明负极附近溶液中产生了Fe2+,即发生了电化学腐蚀。
查看答案和解析>>
科目: 来源: 题型:
【题目】己知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用下图所示装置电解,其中某电极增重ag,另一电极上产生标准状况下的气体VmL。下列说法正确的是

A. 铜电极连接电源正极 B. 铜的相对原子质量的计算式是![]()
C. 黑色粉末X是铁粉 D. 石墨电极上发生的反应是4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】燃料电池是利用燃料(如CO、H2、CH4等)与氧气反应,将反应产生的化学能转变为电能的装置,通常用氢氧化钾作为电解质溶液。完成下列关于甲烷(CH4)燃料电池的填空:
(1)甲烷与氧气反应的化学方程式为:
(2)已知燃料电池的总反应式为CH4+2O2+2KOH=K2CO3+3H2O,电池中有一极的电极反应为CH4+10OH--8e-= CO32-+7H2O,这个电极是燃料电池的 (填“正极”或“负极”),另一个电极上的电极反应式为:
(3)随着电池不断放电,电解质溶液的碱性 (填“增大”、“减小”或“不变”)
(4)通常情况下,甲烷燃料电池的能量利用率 (填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活、社会发展息息相关,下列说法不正确的是( )
A.“霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应
B.“熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应
C.屠呦呦提取青蒿素加入乙醚萃取,此过程属于化学变化
D.“春蚕到死丝方尽,蜡炬成灰泪始干”诗句中涉及化学变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com