
科目: 来源: 题型:
【题目】现有(NH4)2SO4和NH4NO3的混合溶液,向该混合溶液中逐滴加入Ba(OH)2溶液,并加热使之充分反应,直至Ba(OH)2溶液过量。加入Ba(OH)2溶液的体积与产生沉淀的质量和放出NH3的体积(标准状况下)的关系如下图,曲线a代表沉淀的质量变化,曲线b代表NH3的体积变化(假设NH3全部放出)。
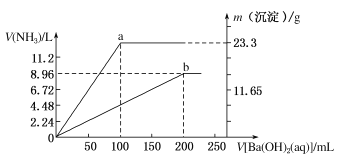
(1)混合溶液中NH![]() 的物质的量为________mol。
的物质的量为________mol。
(2)混合溶液中NO![]() 的物质的量为________mol。
的物质的量为________mol。
(3)当加入Ba(OH)2溶液的体积在100~200mL范围内,发生反应的离子方程式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.对于4FeS2+11O2═2Fe2O3+8SO2,试回答有关的问题:
(1)常选用哪些物质浓度的变化来表示该反应的速率____________;
(2)为了提高生成SO2的速率,可以采取的措施是______________;
A.增加FeS2的量 B.增大O2的浓度 C.升高温度 D.减小压强
Ⅱ.某可逆反应在某体积为5L的密闭容器中进行,在从0﹣3分钟各物质的量的变化情况如图所示(A,B,C均为气体)
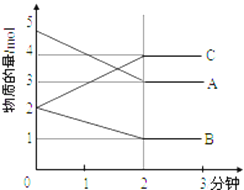
(3)该反应的化学方程式为_________________;
(4)在一定温度下,体积不变的密闭容器中,上述反应达到平衡的标志是_______________
A.气体总质量保持不变
B.A、B、C的浓度都相等
C.A、B、C的浓度不再发生变化
D.A、B、C的分子数之比为2:1:2
E.正反应和逆反应都已停止
F.容器内气体密度不再发生变化.
查看答案和解析>>
科目: 来源: 题型:
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是( )
A.K2CO3和K2O都属于盐
B.KOH和Na2CO3都属于碱
C.H2SO4和HNO3都属于酸
D.Na2O和Na2SiO3都属于氧化物
查看答案和解析>>
科目: 来源: 题型:
【题目】天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣889.6kJ/mol.
(1)反应物能量总和_____(填“大于”、“小于”或“等于”)生成物能量总和.
(2)若1mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量_____889.6kJ.(填“>”、“<”或“=”)
(3)已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g)=2H2O(l)△H=﹣572kJ/mol,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是_____.
(4)被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点.
①已知甲烷燃料电池的总反应式为CH4+2O2+2KOH═K2CO3+3H2O,通入甲烷的这个电极是_____(填“正极”或“负极”),其另外一电极上的电极反应式为:__________________.
②通常情况下,甲烷燃料电池的能量利用率_____(填“大于”、“小于”或“等于”)甲烷燃烧的能量利用率.
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述中不正确的是( ) ①12.4g白磷晶体中含有的P﹣P键数约是0.6NA;
②电解精炼铜时转移了NA个电子,阳极溶解32g铜;
③7.8g Na2S和Na2O2的混合物中含有的阴离子数大于0.1NA;
④2mol SO2和1mol O2混合在V2O5存在的条件下于密闭容器中加热反应后,容器内物质分子数大于2NA;
⑤2.9g 2CaSO4H2O含有的结晶水分子数为0.02NA (2CaSO4H2O式量为290);
⑥1molFeCl3与沸水反应生成胶体后,含有NA个Fe(OH)3胶粒;
⑦含0.1mol溶质Na2CO3的溶液中,所含阴离子总数大于0.1NA .
A.①②③④⑤⑦
B.②③⑤⑥
C.①③④⑤⑥
D.③④⑤⑥⑦
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.(1)把一块纯净的锌片插入盛有稀硫酸的烧杯中,可观察到锌片逐渐溶解,并有气泡产生;平行地插入一块铜片(如图甲装置所示),可观察到铜片上________(填“有”或“没有”)气泡产生;若用导线把锌片和铜片连接起来(如图乙装置所示),可观察到铜片上________(填“有”或“没有”)气泡产生。
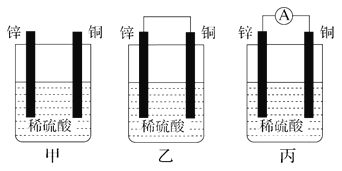
(2)用导线将电流表的两端与溶液中的锌片和铜片相连(如图丙装置所示),观察到电流表的指针发生了偏转,说明导线中有电流通过。锌片上的电极反应:______________;铜片上的电极反应:____________________________。
(3)乙、丙装置是将________能转化为________能的装置。
Ⅱ.断开1molH﹣H键,1molN﹣H键,1molN≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,求:
(1)1molN2生成NH3需_____(填“吸收”或“放出”)能量_____ kJ
(2)1molH2生成NH3需_____(填“吸收”或“放出”)能量_____ kJ(不考虑可逆反应)
查看答案和解析>>
科目: 来源: 题型:
【题目】铝及其合金在生活、生产中有广泛应用。
(1)最新研究表明:氢氧化铝溶于氢氧化钠溶液中生成Na[Al(OH)4]。则氢氧化铝在水中发生酸式电离的电离方程式为________________________________。
(2)目前,国内对真空碳热还原-氯化法冶炼铝的研究较多,利用该方法冶炼金属铝,既节能又环保。
已知:①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1
②3AlCl(g)====2Al(l)+AlCl3(g) △H2
③Al(l)====Al(s) △H3
则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=___________(用含△H1、△H2、△H3的代数式表示)。
(3)已知:Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g) ![]() c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
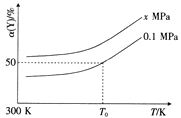
①上述反应的△H_______0(填“>”“<”或“=”)。
②图象中,x_________0.1(填“>”“<”或“=”)。
③在T0K、0.1MPa时,上述反应的平衡常数K=____________。
④提高上述反应的反应速率的措施有_______________________________ (任填二项)。
⑤从上述反应体系中分离出H2(还含有少量CO)作为合成氨的原料气,为避免CO使催化剂中毒,原料气在通入合成塔之前需与适量NH3混合,并用[Cu(NH3)2]Ac溶液吸收CO,反应原理为[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
(4)我国首创的海水电池以铝板为负极,以接触空气的铁铂合金网为正极,以弱碱性的海水为电解质溶液,电池总反应为4Al+3O2+6H2O===4Al(OH)3。试写出海水电池的正极反应式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,集气瓶内充满某混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体是( )

①CO、O2 ②Cl2、CH4 ③NO2、O2 ④N2、H2
A. ①② B. ②④ C. ③④ D. ②③
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下列实验装置进行的相应实验,不能达到实验目的是( ) 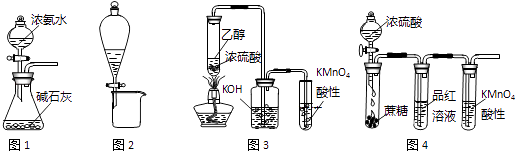
A.图1装置可制取氨气
B.图2装置可分离CH3COONa和CH3COOC2H5混合液
C.图3所示装置可制取乙烯并验证其易被氧化
D.图4所示装置可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com