
科目: 来源: 题型:
【题目】把铝、铁混合物 1.1g 溶于200mL 5molL ﹣1盐酸中,反应后盐酸的浓度变为4.6molL ﹣1(溶液体积变化忽略不计).求:
(1)反应中消耗HCl的物质的量.
(2)该混合物中铝、铁的物质的量.
查看答案和解析>>
科目: 来源: 题型:
【题目】为倡导“节能减排”和“低碳经济”,目前工业上有一种方法是用CO2来生产燃料乙醇。一定条件下发生反应:2CO2(g)+6H2(g)![]() CH3CH2OH(g)+3H2O(g) ΔH<0。
CH3CH2OH(g)+3H2O(g) ΔH<0。
(1)在一定条件下,在20 L密闭容器中按物质的量比为1∶3充入CO2和H2,温度在450 K,n(H2)随时间变化如表所示:
t/min | 0 | 1 | 3 | 5 |
n(H2)/mol | 8 | 6 | 5 | 5 |
在450 ℃、0~1 min,v(CH3CH2OH)=________;此温度下该反应的化学平衡常数为________(结果保留三位有效数字)。
(2)在5 MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:

曲线乙表示的是 ________(填物质的化学式)的体积分数,图像中A点对应的体积分数b=________%(结果保留三位有效数字)。
(3)下列措施中能使化学平衡向正反应方向移动的是________。
A.升高温度
B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l mol CO2和3 mol H2
(4)25 ℃、1.01×105Pa时,9.2 g液态乙醇完全燃烧,当恢复到原状态时,放出273.4 kJ的热量,写出表示乙醇燃烧的热化学方程式:________________________。
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料,可以制成乙醇的燃料电池,写出发生还原反应的电极反应式:_____________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】还原沉淀法是处理含铬(含Cr2O72﹣和CrO42﹣)工业废水的常用方法,过程如下:
![]()
己知转化过程中反应为:2CrO42﹣(aq)+2H+(aq)![]() Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
Cr2O72﹣(aq)+H2O(1)。转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣。下列说法不正确的是
A. 溶液颜色保持不变,说明上述可逆反应达到达平衡状态
B. 若用绿矾(FeSO4·7H2O)(M=278)作还原剂,处理1L废水,至少需要917.4g
C. 常温下转化反应的平衡常数K=1×1014,则转化后所得溶液的pH=6
D. 常温下Ksp[Cr(OH)3]=1×10﹣32,要使处理后废水中c(Cr3+)降至1×10﹣5mol/L,应调溶液的pH=5
查看答案和解析>>
科目: 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是( )
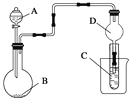
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】肉桂酸甲酯(H)是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。利用红外光谱仪可初步检测有机化合物中的某些基团,现测得H分子的红外光谱如下图所示:
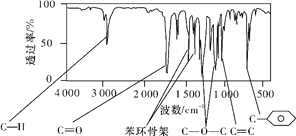
又知J为肉桂酸甲酯的一种同分异构体,其分子结构模型如下图所示(图中球与球之间的连线表示单键或双键等化学键)。

试回答下列问题:
(1)肉桂酸甲酯(H)的结构简式为_______。
(2)现测出A的核磁共振氢谱图有6个峰,且面积之比为1∶2∶2∶2∶1∶2。用芳香烃A为原料合成H的路线如下(部分反应物和反应条件已略去):
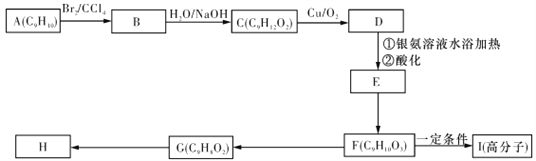
①化合物F中的官能团有__________(填名称)。
②F→G的反应类型是__________。
③书写下列化学方程式:
F→I:____________________。
G→H:_________________________。
④其中F的同分异构体甚多,其中有一类可用通式![]() 表示(其中X、Y均不为氢原子),试写出符合上述通式且能发生银镜反应的四种物质的结构简式:_____________________。
表示(其中X、Y均不为氢原子),试写出符合上述通式且能发生银镜反应的四种物质的结构简式:_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】密闭容器中进行如下反应:X(g)+3Y(g)![]() 2Z(g),X、Y、Z起始浓度分别是0.2mo1/L、0.6mol/L、0.4mol/L,当达到平衡时,下列数据可能正确的是
2Z(g),X、Y、Z起始浓度分别是0.2mo1/L、0.6mol/L、0.4mol/L,当达到平衡时,下列数据可能正确的是
A. X为0.25mol/L,Z为0.5mol/L B. Y为1.2mo1/L
C. X为0.3mol/L,Z为0.3mol/L D. Z为0.6mo1/L
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸常用于金属表面除锈.(原理:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O)
(1)把50g质量分数为98%的浓硫酸,稀释成10%的稀硫酸,需要水的质量是多少?
(2)要使16gFe2O3恰好完全反应,需消耗上述10%的稀硫酸的质量是多少?
查看答案和解析>>
科目: 来源: 题型:
【题目】取一定量的Na2CO3、NaHCO3和Na2SO4混合物与250mL 1.00molL﹣1过量盐酸反应,生成2.016L CO2(标准状况),然后加入500mL 0.100molL﹣1Ba(OH)2溶液,得到沉淀的质量为2.33g,溶液中过量的碱用10.0mL 1.00mlL﹣1盐酸恰好完全中和.计算:
(1)混合物中Na2SO4的质量;
(2)混合物中Na2CO3的物质的量.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com