
科目: 来源: 题型:
【题目】在无色透明溶液中,下列各组中的离子一定能大量共存的是
A. K+、Fe2+、NO3-、H+ B. Na+、Ca2+、Cl-、NO3-
C. Na+、H+、Cl-、CO32- D. Na+、Cu2+、OH-、SO42-
查看答案和解析>>
科目: 来源: 题型:
【题目】将钠、镁、铝各0.3 mol分别放入100 mL 1 mol·L-1的盐酸中,同温同压下产生的气体体积比是( )
A. 1∶2∶3 B. 3∶1∶1 C. 6∶3∶2 D. 1∶1∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】新型电池在飞速发展的信息技术中发挥着越来越重要的作用。Li2FeSiO4是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用。其中一种制备Li2FeSiO4的方法为:固相法:2Li2SiO3+FeSO4![]() Li2FeSiO4+Li2SO4+SiO2
Li2FeSiO4+Li2SO4+SiO2
某学习小组按如下实验流程制备Li2FeSiO4并测定所得产品中Li2FeSiO4的含量。
实验(一)制备流程:
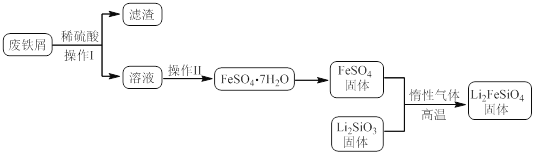
实验(二) Li2FeSiO4含量测定:
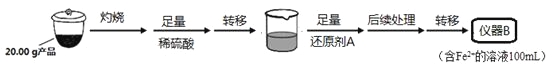
从仪器B中取20.00 mL溶液至锥形瓶中,另取0.2000 mol·Lˉ1的酸性KMnO4标准溶液装入仪器C中,用氧化还原滴定法测定Fe2+含量。相关反应为:MnO4- +5Fe2++8H+=Mn2++5Fe3++4H2O,杂质不与酸性KMnO4标准溶液反应。经4次滴定,每次消耗KMnO4溶液的体积如下:
实验序号 | 1 | 2 | 3 | 4 |
消耗KMnO4溶液体积 | 20.00 mL | 19.98mL | 21.38mL | 20.02mL |
(1)实验(二)中的仪器名称:仪器B ,仪器C 。
(2)制备Li2FeSiO4时必须在惰性气体氛围中进行,其原因是 。
(3)操作Ⅱ的步骤 ,在操作Ⅰ时,所需用到的玻璃仪器中,除了普通漏斗、烧杯外,还需 。
(4)还原剂A可用SO2,写出该反应的离子方程式 ,此时后续处理的主要目的是 。
(5)滴定终点时现象为 ;根据滴定结果,可确定产品中Li2FeSiO4的质量分数为 ;若滴定前滴定管尖嘴处有气泡,滴定后消失,会使测得的Li2FeSiO4含量 。(填“偏高”、“偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,化合物XZ是水煤气的主要成分之一,下列说法不正确的是
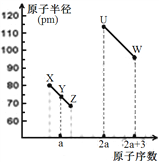
A. U、X、W 三种元素最高价氧化物对应的水化物酸性依次增强
B. 由Y、Z和氢三种元素形成的化合物中一定只含共价键
C. XZ2与X60的化学键类型和晶体类型都相同
D. X的位置是第2周期、第ⅣA族
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 一定条件下,乙酸乙酯、葡萄糖、蛋白质都能与水发生水解反应
B. 蛋白质溶液中加入饱和硫酸铵溶液,蛋白质发生变性
C. 全降解塑料![]() 可由环氧丙烷
可由环氧丙烷![]() 和CO2缩聚制得
和CO2缩聚制得
D. 植物秸杆的主要成分是纤维素,纤维素在催化剂作用下经水解可得葡萄糖,葡萄糖在酒化酶的作用下能转化为酒精
查看答案和解析>>
科目: 来源: 题型:
【题目】肼是一种常见的还原剂,不同条件下分解产物不同,60~300℃时,在Cu等金属表面肼分解的机理如下图所示,已知200℃时:Ⅰ.3N2H4(g)= N2(g)+4NH3(g) ΔH1=-32.9kJ·mol-1;
Ⅱ.N2H4(g)+H2(g)= 2NH3(g) ΔH2=-41.8kJ·mol-1。
下列说法不正确的是

A. 肼属于共价化合物
B. 图示过程①、②都是吸热反应
C. 反应Ⅰ中氧化剂与还原剂的物质的量之比为2∶1
D. 200℃时,肼分解的热化学方程式为N2H4(g)= N2(g)+2H2(g) ΔH=+50.7kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知A为淡黄色固体,T、R为两种常见的用途很广的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀,W溶液中加入KSCN出现血红色. 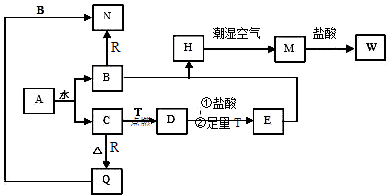
(1)写出下列物质的化学式:A , D , E , R , T .
(2)B与E混和得到H并在潮湿空气中变成M的过程中,可能观察到的现象: .
(3)按要求写方程式:B和R反应生成N的离子方程式:;M→W的离子方程式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用最广泛的能源.
(1)在25℃、101kPa下,16g的甲烷完全燃烧生成CO2和液态水时放出a kJ(a>0)的热量,则表示甲烷燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关. ①图1是N2(g)和H2(g)发生反应生成1mol NH3(g)过程中的能量变化示意图,该反应过程是(填“放热”或“吸热”)过程,请写出生成2mol NH3的热化学方程式: . 
②已知:
化学键 | H﹣H | N≡N |
键能(kJ/mol) | 435 | 943 |
试根据上表及图1中的数据计算N﹣H键的键能为kJ/mol.
③若起始时向容器内放入1mol N2和3mol H2 , 10分钟后N2的转化率为15%,则该反应进行到此时共放出的热量为kJ.
(3)①二氧化碳的捕集、利用是我国能源领域的一个重要研究方向.工业上用CO2和H2反应合成二甲醚.已知: CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H1=﹣53.7kJ/mol
CH3OCH3(g)+H2O (g)═2CH3OH(g)△H2=+23.4kJ/mol
则:2CO2(g)+6H2(g)CH3OCH3 (g)+3H2O(g)△H3=kJ/mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】实验室配制500mL浓度为2mol/L的NaOH溶液.选用容量瓶的规格和所需NaOH的质量分别为( )
A.100 mL 容量瓶、40 g
B.500 mL 容量瓶、40 g
C.100 mL 容量瓶、80 g
D.500 mL 容量瓶、80 g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com