
科目: 来源: 题型:
【题目】电动自行车由于灵活、快捷、方便,已成为上班族的主要代步工具,其电源常采用铅蓄电池。反应原理为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l)。根据此反应判断下列叙述错误的是( )
2PbSO4(s)+2H2O(l)。根据此反应判断下列叙述错误的是( )
A. 放电时负极反应为:Pb(s)+SO![]() (aq)-2e-===PbSO4(s)
(aq)-2e-===PbSO4(s)
B. 充电时电能转化为化学能
C. 放电时,电解液的密度增大
D. 充电时,电解液的pH减小
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A.1 mol O的质量是 32g/mol
B.OH﹣的摩尔质量是17g
C.1mol H2O的质量是18g/mol
D.CO2的摩尔质量是44g/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下的定容容器中,当下列哪些物理量不再发生变化时,表明反应A(g)+2B(g)![]() C(g)+D(g)已达到平衡状态
C(g)+D(g)已达到平衡状态
①混合气体的压强 ②混合气体的密度 ③ B的物质的量浓度 ④ 混合气体的总物质的量 ⑤混合气体的平均相对分子质量 ⑥v(C)与v(D)的比值 ⑦混合气体的总质量 ⑧混合气体的总体积 ⑨C、D的分子数之比为1∶1
A. ①②③④⑤⑥⑦⑧ B. ①③④⑤ C. ①②③④⑤⑦ D. ①③④⑤⑧⑨
查看答案和解析>>
科目: 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细化工产品,具有较强还原性,回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式: .
(2)H3PO2中,磷元素的化合价为 .
(3)NaH2PO2是正盐还是酸式盐?其溶液显性(填弱酸性、中性、或者弱碱性).
(4)H3PO2也可以通过电解的方法制备.工作原理如图所示(阳膜和阴膜分别只允许阳离子,阴离子通过): 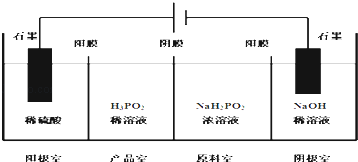
①写出阴极的电极反应式 .
②分析产品室可得到H3PO2的原因 .
③早期采用“三室电渗析法”制备H3PO2 , 将“四室电渗析法”中阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,其缺点是杂质.该杂质产生的原因是: .
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年5月9日,最新发现的第113号、115号、117号和118号元素终于有了中文名称

根据元素周期律知识,下列预测或说法肯定不合理的是( )
A. Nh的最高价氧化物对应的水化物的化学式为H3NhO3是一种强酸
B. Mc的最高价阳离子为Mc5+,氧化性比较弱
C. Og是第七周期中的最后一种元素,其原子序数是所有已发现元素中最大的
D. 根据金属和非金属的分界线,Ts的中文名称为“钿”可能更合理
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于物质结构和化学用语的说法正确的是( )
A. BF3、CCl4中所有原子均达到8电子稳定结构
B. 18gH2O和D2O的中子数都为10NA个
C. 78 g Na2O2晶体中所含离子数目为3NA
D. 氯气与NaOH反应的过程中,同时有离子键、极性键和非极性键的断裂和形成
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在稀溶液中,强酸跟强碱发生中和反应生成1mol水时的反应热叫做中和热。现利用如图装置进行中和热的测定,请回答下列问题:
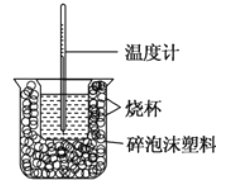
(1)图中缺少的仪器或用品有______、______。
(2)做一次完整的中和热测定实验,温度计需使用_____次。
(3)把温度为15.0℃,浓度为0.5mol/L的酸溶液和0.55mol/L的碱溶液各50mL混合(溶液密度均为1g/mL),生成溶液的比热容c=4.18 J·g-1·℃-1,轻轻搅动,测得酸碱混合液的温度变化数据如下:
反应物 | 起始温度t1/℃ | 终止温度t2/℃ | 中和热 |
HCl+NaOH | 15.0 | 18.3 | △H1 |
HCl+NH3·H2O | 15.0 | 18.0 | △H2 |
①计算表格中第一组实验测出的中和热△H1=______(保留一位小数)。
②写出表格中第二组实验的热化学方程式:_______________(保留一位小数)。
③两组实验结果差异的原因是________________。
④碱溶液过量的原因是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素A、B、C、D、E、F的原子序数依次增大,它们的原子核外电子层数之和为13。B的化合物种类繁多,数目庞大;C、D是空气中含量最多的两种元素,D、E两种元素的单质反应可以生成两种不同的离子化合物;F为同周期原子半径最小的元素。试回答以下问题:
(1)F元素名称为_______,在周期表中的位置是_____________。
(2)用电子式表示D与B以1:1的原子个数比形成的化合物的形成过程__________。
(3)化合物BD2中存在的化学键为_____键(填“离子”或“极性”或“非极性”)。A、C、F三种元素形成的化合物CA4F为______化合物(填“离子”或“共价”)。
(4)化合物甲、乙由A、B、D、E中的三种或四种组成。且甲、乙的水溶液均呈碱性,且乙可以用于治疗胃酸过多。则甲、乙反应的离子方程式为____________。
(5)A、C、D、E的原子半径由大到小的顺序是_________(用元素符号表示)。
(6)B的非金属性___于F(填“强”或“弱”),并用化学方程式证明上述结论:_________。
(7)B的最简单氢化物可作为燃料电池的___极,写出熔融碳酸钠介质中负极电极反应式:_____。
查看答案和解析>>
科目: 来源: 题型:
【题目】羰基硫(O=C=S)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染。羰基硫的氢解反应和水解反应是两种常用的脱硫方法,其反应式分别为:
①氢解反应:COS(g)+H2(g)![]() H2S(g)+CO(g) △H1=+7kJ/mol
H2S(g)+CO(g) △H1=+7kJ/mol
②水解反应:COS(g)+H2O(g)![]() H2S(g)+CO2(g) △H2
H2S(g)+CO2(g) △H2
已知反应中相关的化学键键能数据如下:
化学键 | C=O(CO2) | C=O(COS) | C=S | H-S | H-O |
E/kJ·mol-1 | 803 | 742 | 577 | 339 | 465 |
回答下列问题:
(1)在以上脱除COS的反应中,若某反应有1mol电子发生转移,则该反应吸收的热量为____kJ。
(2)已知热化学方程式CO(g)+H2O(g)![]() H2(g)+CO2(g) △H3,则△H3=_____kJ/mol。
H2(g)+CO2(g) △H3,则△H3=_____kJ/mol。
(3)某温度下,在某密闭容器中进行COS的氢解反应
①当反应达到限度后,增大容器的体积,则正反应速率_____(填“增大”“减小”或“不变”);
②当容器体积不变时,若起始时充入COS和H2的体积比为1:2,下列情形能表明反应达到平衡状态的是______。
a.气体密度不变 b.COS与H2浓度比不变
c.混合气体的平均相对分子质量不变 d.COS体积分数不变
③当容器体积不变时,若COS和H2的起始物质的量比为1:a,平衡后COS和H2的物质的量比为1:10a,则此温度下H2平衡转化率为______(用含a的式子表示)。
(4)羰基硫的氢解或水解反应能否设计成原电池_____(能或否),理由是________。
(5)用金属储氢材料(MH)、铂(Pt)、硫酸溶液组成的原电池可以使羰基硫脱硫处理。
①原电池的负极材料是____(填化学式)。
②写出原电池的正极反应式_________,正极周围溶液pH______(填“增大”“减小”或“不变”)。
③原电池工作时,硫酸溶液的作用是___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】对于反应中的能量变化,表述正确的是( )
A.放热反应中,反应物的总能量大于生成物的总能量
B.断开化学键的过程会放出能量
C.加热才能发生的反应一定是吸热反应
D.酸碱中和反应都是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com