
科目: 来源: 题型:
【题目】海水开发利用的部分过程如图所示.下列说法错误的是( ) 
A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目: 来源: 题型:
【题目】化合物 J 是某种解热镇痛药,以 A 为原料的工业合成路线如下图所 示:

已知
分子式 B: C8H8O2 C:C8H7NO4 D:C6H5NO3 E :C6H7NO F:C9H11NO2 H:C6H 7O3
(1)写出同时符合下列条件的 F 的所有同分异构体的结构简式_____
①属 a—氨基酸:(a 碳上须含有氢原子) ② NMR 谱表明分子中含有苯环
(2)下列说法不正确的是_____
A.化合物 C 中含氧官能团有两种
B.化合物 E 既可以与 NaOH 反应又可以与 HCl 反应
C.化合物 F 能与 FeCl3 发生显色反应
D.化合物 J 的分子式为 C18H15NO5
(3)设计 G→H 的合成路线(用流程图表示,无机试剂任选)_____
(4)写出 I+F→J 的化学方程式_____
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯化六氨合钴(Ⅲ)是一种重要的配合物原料,实验室制备实验流程如下:

已知:[Co(NH3)6]Cl3在水中电离为[Co(NH3)6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
温度(℃) | 0 | 20 | 47 |
溶解度(g) | 4.26 | 6.96 | 12.74 |
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸与研细的目的是__
(2)实验室制备三氯化六氨合钴(III)的化学方程式为:____________
(3)实验操作1为 _________[Co(NH3)6]Cl3溶液中加入浓盐酸的目的是_____
(4)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:[Co(NH3)6]Cl3+3NaOH![]() Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。
Co(OH)3↓+6NH3↑+3NaCl(装置见右下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水。加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端外壁上粘附的酸液于C中,加入2-3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。

已知: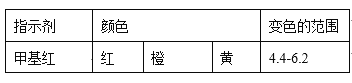
①当滴定到终点时,共需消耗NaOH溶液___mL(准确到0.01mL)。
②当用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将______(填“偏大”、“偏小”或“不变”)
查看答案和解析>>
科目: 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A.1mol羟基中含有的电子数为10NA
B.标准状况下,22.4 L CCl4含有的分子总数为NA
C.46g组成为C2H6O的有机物,C﹣H键数目一定为5NA
D.常温常压下,9g甲烷(14CH4)所含的中子数为4NA
查看答案和解析>>
科目: 来源: 题型:
【题目】将等物质的量的A和B,混合于2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(g),5min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
xC(g)+2D(g),5min后测得c(D)=0.5 mol/L,c(A):c(B)=1:2,C的反应速率是 0.15 mol/(Lmin)。
(1)B的反应速率v(B)=__________________X=____________
(2)A在5min末的浓度是________________
(3)此时容器内的压强与开始时之比为:___________。
(4)二氯化硫(S2Cl2)是一种琥珀色液体,是合成硫化染料的重要原料。
a. 写出它的电子式______________;
b. 指出它分子内的键型______________。
c. 指出硫元素的化合价为______________。
(5)硒的原子序数为34,硒的单质及其化合物用途非常广泛。
a.硒在元素周期表中的位置是___________。Se2Cl2常用作分析试剂,其结构式为_______。
b.硒化铟是一种可应用于未来超算设备的新型半导体材料。已知铟(In)与铝同族且比铝多两个电子层。下列说法正确的是________(填字母)。
A.原子半径:In>Se B.In的金属性比Se强
C.In的金属性比Al弱 D.硒化铟的化学式为InSe2
c.推测SeO2的化学性质(任写一条即可)_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是煤化工产业链的一部分,试运用所学知识,解决下列问题: 
(1)已知该产业链中某反应的平衡表达式为:K= ![]() ,它所对应反应的化学方程式为;
,它所对应反应的化学方程式为;
(2)二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用,工业上以CO和H2为原料生产CH3OCH3 . 工业制备二甲醚在催化反应室中(压力2.0~10.0Mpa,温度230~280℃)进行下列反应: ①CO(g)+2H2(g)CH3OH(g)△H1=﹣90.7kJmol﹣1
②2CH3OH(g)CH3OCH3(g)+H2O(g)△H2=﹣23.5kJmol﹣1
③CO(g)+H2O(g)CO2(g)+H2(g)△H3=﹣41.2kJmol﹣1
(i)催化反应室中总反应的热化学方程式为 , 830℃时反应③的K=1.0,则在催化反应室中反应③的K1.0(填“>”、“<”或“=”).
(ii)在某温度下,若反应①的起始浓度分别为:c(CO)=1mol/L,c(H2)=2.4mol/L,5min后达到平衡,CO的转化率为50%,若反应物的起始浓度分别为:c(CO)=4mol/L,c(H2)=a mol/L;达到平衡后,c(CH3OH)=2mol/L,a=mol/L.
(iii)反应②在t℃时的平衡常数为400,此温度下,在0.5L的密闭容器中加入一定量的甲醇,反应到某时刻测得各组分的物质的量浓度如下:
物质 | CH3OH | CH3OCH3 | H2O |
c/(molL﹣1) | 0.8 | 1.24 | 1.24 |
①此时刻,v正v逆(填“大于”、“小于”或“等于”).
②平衡时二甲醚的物质的量浓度是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某化工厂为了综合利用生产过程中的副产品CaSO4 , 与相邻的合成氨厂联合设计了以下制备(NH4)2SO4的工艺流程.回答下列问题: 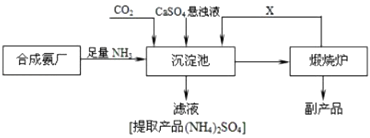
(1)工业合成氨所需氮气来自空气,常用物理方法获;该方法是;
(2)工业合成氨反应的化学方程式是
(3)沉淀池中发生反应的主要方程式是
(4)上述生产流程中,有关NH3的作用及说明正确的是 A.提供制各产品所需的氮元素
B.增大CO32﹣的浓度促进反应发生
C.作反应的催化剂
(5)可以循环使用的X是 . 从绿色化学和资源综合利用的角度说明上述流程的主要优点是 .
(6)写出硫酸钙的其它一种用途 .
查看答案和解析>>
科目: 来源: 题型:
【题目】如表是a~m九种元素在周期表中的位置,请回答下列问题:
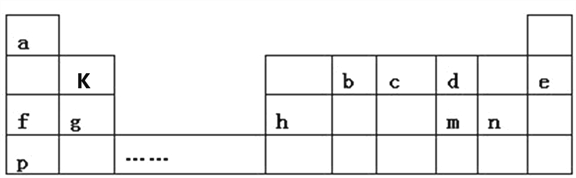
(1)m的阴离子结构示意图为____________。
(2)b的最高价氧化物的电子式为____________;用电子式表示f2 d2的形成过程_______________________。
(3)d、g、n形成的简单离子的半径由大到小的顺序为___________(用离子符号填写)。
(4)f、g、p的最高价氧化物的水化物碱性从强到弱的顺序为__________(填化学式)。
(5)p和n两种元素最高价氧化物的水化物相互反应的化学反应方程式为___________。
(6)c的氢化物和c的最高价氧化物对应水化物之间反应的化学方程式为__________。
(7)k的氧化物与氢氧化钠溶液反应的离子方程式为________________________。
(8)以上元素组成的物质有下列框图中的转化关系,其中甲为10电子微粒。

①丁属于_____________(选填“离子化合物”或“共价化合物”)。
②请写出h单质与乙反应的化学方程式_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在生活和生产中应用广泛。
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:2N2(g)+6H2O(1)![]() 4NH3(g)+3O2(g)
4NH3(g)+3O2(g) ![]() H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1)
H=+1530 kJ·mol-1,又知:H2O(g) = H2O(1) ![]() H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g)
H=-44.0 kJ·mol-1,则4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)
2N2(g)+6H2O(g) ![]() H =_____kJ·mol-1。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____。(填字母)
H =_____kJ·mol-1。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____。(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.采用更好的催化剂 D.降低反应的温度
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。_______________。
CO(NH2)2(s)+H2O(g)△H<0,某温度下,向容器为1L的密闭容器中通入4 mol NH3和2molCO2,该反应进行到40s时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线。_______________。
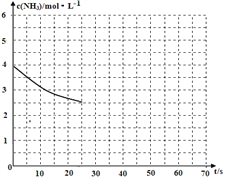
② 若保持温度和容器体积不变,向平衡体系中再通入2molNH3和2molH2O,此时v正______v逆(填“>”、“=”或“<”)
(3)叠氮酸钠(NaN3)常用于汽车安全气囊中,工业 生产NaN3主要是在175℃时把NaNO3粉末加到熔化的NaNH2中,此外还生成两种常见的碱性物质,请写出上述过程的化学方程式_______________________。
(4)羟胺NH2OH可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2 . 某同学在实验室中对NH3与NO2反应进行了探究.回答下列问题:
(1)氨气的制备 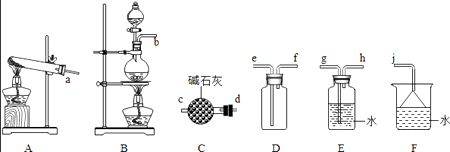 ①氨气的发生装置可以选择上图中的 , 反应的化学方程式为 .
①氨气的发生装置可以选择上图中的 , 反应的化学方程式为 .
②欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→(按气流方向,用小写字母表示).
(2)氨气与二氧化氮的反应 将上述收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好).在一定温度下按图示装置进行实验.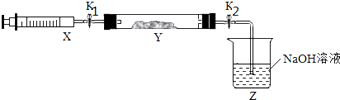
操作步骤 | 实验现象 | 解释原因 |
打开K1 , 推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中 | ②反应的化学方程式 |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③ | ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com