
科目: 来源: 题型:
【题目】氧化还原反应在生产、生活中应用广泛,用所学知识回答问题:
(1)联氨是一种可燃性液体,可用作火箭燃料。已知32.0gN2H4和H2O2反应生成氮气和水(气态),放出热量642kJ,该反应的热化学方程式是:____________。
(2)取300mL0.2mo/L的KI溶液与一定量的KMnO4溶液恰好反应,生成等物质的量I2和KIO3,则消耗KMnO4的物质的量是__________mol。
(3)以甲醇(CH3OH) 为燃料的电池中,电解质溶液为碱性,则负极的电极反应为:__________。
(4)二氧化氯是目前国际上公认的最新一代的高效、广谱、安全的杀菌、保鲜剂。我国科学家研发了用氯气氧化亚氯酸钠(NaClO2) 固体制备二氧化氯的方法,其化学方程式为___________。
(5)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是__________,又变为棕黄色的原因是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在2L密闭容器中进行反应:mX(g)+nY(g)pZ(g)+qQ(g),式中m、n、p、q为化学计量数.在0~3min内,各物质的量的变化如表所示:
物质 | X | Y | Z | Q |
时间 | ||||
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知:2min内v(Q)=0.075molL﹣1min﹣1 , v(Z):v(Y)=1:2.
(1)2min内Z的反应速率v(Z)= .
(2)试确定以下物质的相关量:起始时n(Y)= , n(Q)= .
(3)方程式中m= , n= , p= , q= .
(4)对于该反应,能增大正反应速率的措施是 A.增大容器体积 B.移走部分Q C.通入大量X D.升高温度.
查看答案和解析>>
科目: 来源: 题型:
【题目】在进行中和热的测定中,下列操作错误的是( )
A.反应前酸、碱溶液的温度要相同
B.测量溶液的温度计要一直插在溶液中
C.为了使反应均匀进行,可以向酸(碱)中分次加入碱(酸)
D.为了使反应更完全,可以使酸或碱适当过量
查看答案和解析>>
科目: 来源: 题型:
【题目】如表所示为元素周期表的一部分,参照元素①~⑨在表中的位置,请回答下列问题:

(1)③、④、⑦的原子半径由大到小的顺序是___________(用元素符号表示)。
(2)下列事实能说明②元素的非金属性比⑥元素的非金属性强的是_______。
A.②的单质与⑥元素的简单氢化物溶液反应,溶液变浑浊
B.在氧化还原反应中,1mol②单质比lmo1⑥单质得电子多
C.②和⑥两元素的简单氢化物受热分解,前者的分解温度高。
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式____________________。
(4)已知周期表中存在对角相似规则,如铍(Be)与铝化学性质相似,⑧的氧化物、氢氧化物也有两性,写出⑧的氢氧化物与④的最高价氧化物的水化物反应的化学方程式_____________。
(5)已知W+X=Y+Z (反应需要加热,),W、X、Y、Z分别是由①②⑨三种元素形成的四种10电子粒子(W、X为离子,Y、Z为分子),写出该化学方程式______________。
(6)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。

①写出D溶液与G反应的离子方程式_______________。
②写出检验A溶液中溶质的阴离子的方法_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下列实验装置可以达到实验目的的是( )
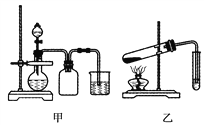
A. 甲装置可以实现Cl2的制取、收集、尾气吸收
B. 乙装置可以实现乙酸乙酯的制取和收集
C. 丙装置可以形成Cu—Zn原电池
D. 丁装置可证明H2CO3的酸性大于H2SiO3
查看答案和解析>>
科目: 来源: 题型:
【题目】向59.2g Fe2O3和FeO的混合物中加入某浓度的稀硝酸1.0L,固体物质完全反应,生成NO和Fe(NO3)3。在所得溶液中加入1.0mol/L的NaOH溶液2.8L,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为85.6g。下列有关说法错误的是 ( )
A. Fe2O3和FeO的物质的量之比为1:6
B. 硝酸的物质的量浓度为3.0mol/L
C. 产生的NO在标准状况下的体积为4.48L
D. Fe2O3和FeO与硝酸反应后剩余0.2molHNO3
查看答案和解析>>
科目: 来源: 题型:
【题目】随着各地治霾力度的加大,大力发展高性能燃料电池汽车成为研究课题。如图是某课题组设计的液体燃料电池示意图。下列有关叙述不正确的是
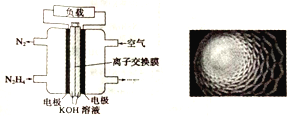
A. 该电池的优点是不产生污染气体,且液体燃料便于携带
B. 电池内部使用的是阴离子交换膜,OH-经交换膜移向负极
C. 该燃料电池的电极材料采用多孔纳米碳材料(如图),目的是增大接触面积,增加吸附量
D. 该电池中通入N2H4的电极为正极,发生的电极反应式为N2H4+4OH--4e-=N2↑+4H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】交通运输部在南海华阳礁举行华阳灯塔和赤瓜灯塔竣工发光仪式,宣布两座大型多功能灯塔正式发光并投入使用。镁海水电池可为灯塔提供能源,其装置如图所示。下列有关镁海水电池的说法正确的是

A. Mg电极上发生还原反应
B. 该电池工作一段时间后,左侧溶液质量减轻
C. 正极的电极反应式为H2O2+2e-+2H+=2H2O
D. 若电池工作时转移2 mol电子,则有2 mol H+由质子交换膜左侧向右侧迁移
查看答案和解析>>
科目: 来源: 题型:
【题目】“纳米材料”是粒子直径为1~100nm的材料,纳米碳就是其中的一种。某研究所将纳米碳均匀的分散到蒸馏水中,得到的物质①是溶液②是胶体③具有丁达尔现象④能透过半透膜⑤能透过滤纸⑥静止后会出现黑色沉淀。其中正确的是
A.①④⑥B.②③⑤
C.②③④D.①③④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com