
科目: 来源: 题型:
【题目】关于100ml1mol/LCaCl2溶液的叙述正确的是
A. Cl-的物质的量浓度为2mol/L
B. CaCl2的物质的量为1mol
C. 取出50 mL后,剩余溶液中CaCl2的物质的量浓度为0.5mol/L
D. 该溶液中水的体积为100 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是某课外小组制取乙炔并测定乙炔的某些性质的实验. 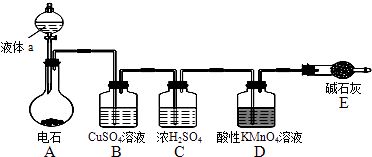
(1)写出实验室制取乙炔的化学方程式: .
(2)实验室制取乙炔时,分液漏斗中的液体a通常是 .
(3)CuSO4溶液的作用是 .
(4)装置D中的现象是: .
(5)工业上常用乙炔、饱和食盐水等物质作原料来合成聚氯乙烯,请写出相关方程式:
; ; ; .
查看答案和解析>>
科目: 来源: 题型:
【题目】血红蛋白(Hb)和肌红蛋白(Mb)分别存在于血液和肌肉中,都能与氧气结合,与氧气的结合度a(吸附O2的Hb或Mb占总Hb或Mb的比例)和氧分压p(O2)密切相关。
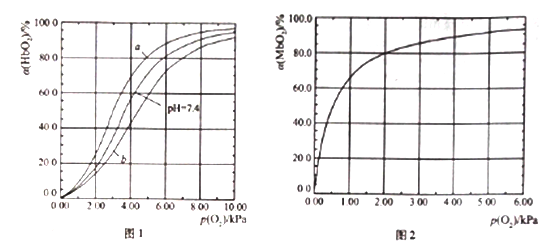
I .Hb与氧气的结合能力还受到c(H+)的影响,平衡如下:
HbO2(aq)+H+(aq) ![]() HbH+(aq)+O2(g) (反应①)。37℃,PH分别为7.2、7.4、7.6 时氧分压p(O2)和达平衡时的结合度的关系如图1
HbH+(aq)+O2(g) (反应①)。37℃,PH分别为7.2、7.4、7.6 时氧分压p(O2)和达平衡时的结合度的关系如图1
(1)图1中pH=7.6时的曲线为______ (填“a”或“b”)。
(2)血液中还存在平衡:CO2+H2O![]() H2CO3
H2CO3![]() H++HCO3-(反应②),用平衡理论解释肺部高氧分压有利于CO2排出体外的原因___________。
H++HCO3-(反应②),用平衡理论解释肺部高氧分压有利于CO2排出体外的原因___________。
II.Mb与氧气结合的平衡如下:Mb(aq)+O2(g) ![]() MbO2(aq)(反应③),37℃时,氧分压p(O2)和达平衡时的结合度的关系如图2。
MbO2(aq)(反应③),37℃时,氧分压p(O2)和达平衡时的结合度的关系如图2。
(3)若肌肉中Mb的初始浓度为c0 mol/L,结合度达到50%所需的时间为t min,此段时间内用MbO2表示的平均反应速率为____________。
(4)图2中a随p(O2)增大而增大的原因是______________。
(5) Mb与氧气结合的平衡常数的表达式K=![]() ,计算37℃时K=____________。
,计算37℃时K=____________。
(6) Mb与氧气结合达平衡时结合度a=____________ [用含p(O2)和K的代数式表示]。
人正常呼吸时,温度约为37℃,空气中氧分压约为20.0kPa,计算此时Mb与氧气的最大结合度为____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】钨是熔点最高的金属,是重要的战略物资,广泛用于钢铁工业,电真空照明材料等方面。黑钨矿是一种有开采价值的钨矿石,其主要成分是铁和锰的钨酸盐(常用FeWO4、MnWO4表示)。它的传统冶炼工艺的第一阶段如下图所示:
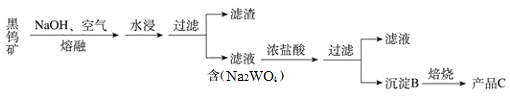
注:①上述流程中钨的化合价不变 ②钨酸(H2WO4)是一种难溶性酸
(1)写出C的化学式:______;写出生成B的化学方程式:_________
(2)上述流程中,第一次过滤所得滤渣的主要成份除MnO2外,还含有_________,请写出FeWO4在熔融条件下发生反应生成该成分的化学方程式_________
(3)冶炼金属钨是用非整比的钨氧化物为原料,钨元素在其中存在两种价态:+5价和+6价,试确定组成为WO2.7的氧化钨中两种对应价态的钨原子个数的整数比为_____________。
(4)黑钨矿还含少量Si、As的化合物,上述流程需优化(见下图)。向含Na2WO4的滤液中加硫酸调节pH=10后,再除杂净化。
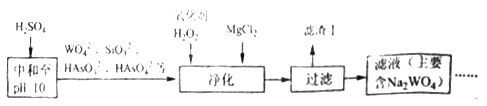
则“净化”过程中,加入H2O2的目的是__________,滤渣Ⅰ的主要成分是____________。
(5)某温度下,Ca(OH)2、CaWO4的相关数据见下表
项目 | CaWO4 | Ca(OH)2 |
-lgc(阴离子) | 4 | 2 |
-lgc(Ca2+) | 6 | 4 |
将钨酸钠溶液加入石灰乳中,发生反应的离子方程式为WO42-(aq)+Ca(OH)2(s) ![]() CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
CaWO4(s)+2OH-(aq)该温度下此反应的平衡常数为______mol/L。
查看答案和解析>>
科目: 来源: 题型:
【题目】有三份白色固体分别为碳酸钠、碳酸氢钠及二者的混合物。某化学课外活动小组对其进行相关实验和探究。
I.甲组同学采用加热的方法确定其成分。
(1)除托盘天平、药匙、三脚架、泥三角、玻璃棒和干燥器外,完成本实验还需要的实验仪器有_________。
(2)该小组同学准确称取一定量的样品m1g,多次加热、冷却、称量直至恒重,质量为m2g。依据得出结论,请完成下表。
m2与m1的关系 | 结论 | |
① | 样品为Na2CO3 | |
② | 样品为NaHCO3 | |
③ | 样品为Na2CO3和 NaHCO3的混合物 |
II.乙组同学利用已鉴别出的NaHCO3和Na2CO3,继续进行实验,对于“能否用CaCl2鉴别的NaHCO3和Na2CO3”的问题进行探究。
(3)小组同学先将NaHCO3、Na2CO3、CaCl2固体分别配制成0.5mol/L的溶液。设汁如下实验方案:
表1
实验方案 | 预测现象 | |
实验1 | 向2mL Na2CO3溶液中滴加1mL CaCl2溶液 | 有白色沉淀生成 |
实验2 | 向2mL NaHCO3溶液中滴加1mL CaCl2溶液 | 无白色沉淀生成 |
若已知:①室温下,0.5mol/L NaHCO3溶液pH=8.5,溶液中c(HCO3-)=0.49 mol/L 。
②室温下, H2CO3的二级电离常数K2=5.6×10-11。
③Ksp(CaCO3)=2.8×10-9。
试估算使0.5mol/L NaHCO3溶液中的CO32-沉淀所需的c(Ca2+)应不低于_____mol/L,并由此得出结论:实验2的预测现象_____(填“正确”或“不正确”)。
⑷实际实验过程发现实验2的现象为白色沉淀并有无色气体生成。此现象对应的离子方程式为_____________。
(5)该小组同学继续设计实验对NaHCO3溶液与CaCl2溶液的反应进行探究,利用气体压力传感器得到的部分实验数据如下:(注:CaCl2溶液浓度相同)
表2 容器内气体浓度达到10000ppm所需时间
C(NaHCO3)/(mol/L) | 所需时间/s | |||
v(CaCl2):v(NaHCO3) | ||||
1:5 | 2:5 | 4:5 | 1:1 | |
1.0 | 142 | 124 | 114 | 156 |
0.5 | 368 | 264 | 244 | 284 |
0.25 | 882 | 450 | 354 | 632 |
0.1 | 1126 | 1316 | 816 | 1816 |
由实验数据可得出的结论是:
①当v(CaCl2):v(NaHCO3)一定时,随着_____,气体逸出速率减小;
②NaHCO3浓度在0.1~1.0mol/L,v(CaCl2)与v(NaHCO3)的比值为____时,气体逸出速率最快,可获得理想的实验观察效果。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 同温同压下H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件的ΔH都相同
B. 已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为-241.8kJ/mol
C. 在稀溶液中H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1,若将含0.5 molH2SO4的浓硫酸与含1 molNaOH的稀溶液混合,放出的热量为57.3 kJ
D. 由N2O4(g) ![]() 2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
2NO2(g) △H=-56.9 kJ·mol-1,可知将1mol N2O4(g)置于密闭容器中充分反应后放出热量为56.9kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol/LCuCl2溶液中滴加0.1 mol/L的Na2S溶液,滴加过程中溶液中lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是
已知:lg2=0.3,Ksp(ZnS)=3×10-25 mol2/L2。
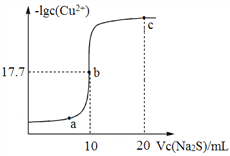
A. a、b、c三点中,水的电离程度最大的为b点
B. Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C. 该温度下Ksp(CuS)=4×10-36 mol2/L2
D. 向100 mL Zn2+、Cu2+浓度均为10-5 molL-1的混合溶液中逐滴加入10-4 molL-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
科目: 来源: 题型:
【题目】已知C(s)+H2O(g)=CO(g)+H2(g) ΔH=+135kJ·mol-1;2C(s)+O2(g)=2CO(g) ΔH=-226 kJ·mol-1。断开1 mol H—H键、O=O键分别需要吸收436 kJ、498 kJ的热量,则断开1 molO—H键需要吸收的热量为( )
A. 462 kJ B. 469 kJ C. 362 kJ D. 466.5 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com