
科目: 来源: 题型:
【题目】下列有关化学反应速率和限度的说法中,不正确的是( )
A. 一定条件下反应I2+H2![]() 2HI中,H2的转化率不能达到100%
2HI中,H2的转化率不能达到100%
B. 在金属钠与足量水反应中,增加水的量能加快反应速率
C. 实验室用碳酸钙和盐酸反应制取CO2,用碳酸钙粉末比块状碳酸钙反应要快
D. 反应N2(g)+3H2(g)![]() 2NH3(g) △H<0达平衡后,升高温度反应速率加快
2NH3(g) △H<0达平衡后,升高温度反应速率加快
查看答案和解析>>
科目: 来源: 题型:
【题目】对于可逆反应2A(g)+3B(g)![]() 4C(g)+2D(g)在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
4C(g)+2D(g)在不同条件下的化学反应速率如下,其中表示的反应速率最快的是( )
A. v(A)=1.0 mol·L-1·min-1 B. v(B)=1.8 mol·L-1·min-1
C. v(D)=0.2 mol·L-1·s-1 D. v(C)=0.6 mol·L-1·min-1
查看答案和解析>>
科目: 来源: 题型:
【题目】三氧化二铬可用作搪瓷、陶瓷、人造革、建筑材料的着色剂。由高碳铬铁合金(含Cr、Fe及C)制备三氧化二铬的工艺流程如下:

已知:Cr(OH)3是两性氢氧化物,草酸亚铁为微溶物。
回答下列问题:
(1)步骤Ⅰ浸取时,为提高浸取速率,除将高碳铬铁合金制成粉末外,还可采取的措施是__________________________(写一点);浸取铬时反应的离子方程式为_______________。
(2)步骤Ⅱ滤渣返回再次浸取的目的是_____________________________________________。
(3)步骤Ⅲ除铁时,溶液的pH对铁的去除率影响如图1所示:

图1 图2
pH小于2.3时,铁去除率低,其原因是_______________________________________。
(4)步骤Ⅳ能说明沉淀已洗涤干净的操作是________________________________________。
(5)步骤Ⅴ沉铬时,生成Cr(OH)3的化学方程式为_____________________________;沉铬时,溶液pH与铬的回收率关系如图2所示,当pH>8.5时,pH越大,铬的回收率越低,其可能原因是____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硝酰氯(NOCl)是有机合成中的重要试剂,可由NO与Cl2在常温常压下合成。已知NOCl是一种红褐色液体或黄色气体,其熔点64.5℃,沸点5.5℃,遇水易水解。
(1)实验室制备原料气NO和Cl2的装置如下图所示:

①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为_______。
②实验室制Cl2时,装置B中盛放的试剂为________,其作用是________。
(2)将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。
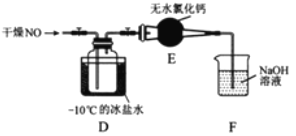
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为________。
②装置D中的现象为________。
③装置E中无水氯化钙的作用为________。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是________。
(3)NO可用间接电化学法除去,其原理如下图所示:

①阴极的电极反应式为______________________。
②吸收塔内发生反应的离子方程式为_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】药物K可用于治疗哮喘、系统性红斑狼疮等。其合成路线如下图所示。
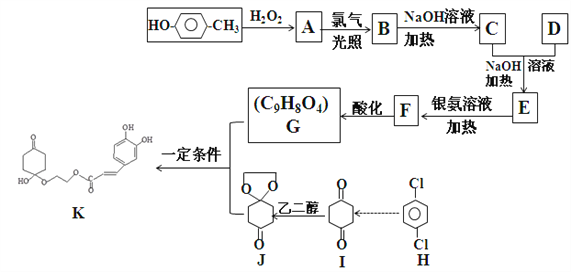
已知:
①通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基
②醛能发生羟醛缩合反应,再脱水生成不饱和醛:
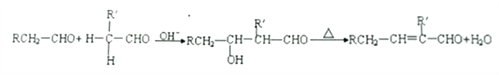
③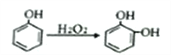
请回答:
(1)下列说法不正确的是_________________;
A.化合物A能与FeCl3发生显色反应
B.化合物C能够发生银镜反应
C.I转化为J属于加成反应
D.K与足量NaOH溶液反应时,1molK最多可消耗3molNaOH
(2)化合物D的结构简式为_____________________________________;
(3)E→F的化学方程式为____________________________________________;
(4)G也可以与环氧丙烷(![]() )发生类似反应G+J→K的反应,其生成物的结构简式为_____________________(写一种);
)发生类似反应G+J→K的反应,其生成物的结构简式为_____________________(写一种);
(5)写出符合下列条件的A的所有同分异构体的结构简式___________________;
①能与氯化铁溶液发生显色反应
②1H-NMR谱显示分子中苯环上有两种不同化学环境的氢原子
(6)通常采用有机物H为原料合成有机物I,请设计该合成路线_________________(用流程图表示,无机试剂任选)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硼及其化合物的研究在无机化学的发展中占有独特的地位。
(1)硼元素有10B和11B两种天然稳定同位素,在基态11B原子中,价电子中存在______对自旋方向相反的电子。第一电离能介于B与N之间的第二周期元素有______种。
(2)目前已制得二十多种硼氢化合物,如乙硼烷B2H6、丁硼烷B4H10等在能源方面前景可期。
①NH3能通过配位键与硼元素的某种氢化物作用得到化合物M, M是一种新的储氢材料,加热M 会缓慢释放出H2,并转化为化合物N, M、N分别是乙烷、乙烯的等电子体。M的结构式为______须标出配位键),氮原子在M、N分子中的杂化方式分别为_________。
②B2H6可作火箭燃料,将B2H6气体通入H2O中的反应为B2H6+6H20=2H3BO3+6H2↑,据此可判断反应中所涉及元素的电负性从小到顺序为_________。
③以硼酸(H3BO3)为原料可制得硼氢化钠(NaBH4),它是有机合成中的重要还原剂,可将竣基直接还原成醇。
CH3C00H ![]() CH3CH2OH
CH3CH2OH 
上图中乙酸分子键角1>键角2,其原因为_____________。
(3)磷化硼(BP)是受高度关注的耐磨材料,可作为金属表面的保护层,其结构与金刚石类似,如图1所示。

①图II是磷化硼沿Z轴的投影图,请在图II中圆球上涂“![]() ”和画“×”分别表明B与P的相对位置_____________。
”和画“×”分别表明B与P的相对位置_____________。
②已知晶胞边长为apm,则磷化硼的密度是______g/cm3(只要求列算式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】设计一个简单的一次性完成实验的装置图,目的是验证醋酸溶液,二氧化碳水溶液、苯酚溶液的酸性强弱顺序. 
(1)利用如图所示的仪器可以组装实验装置,则仪器的连接顺序为:接接接(填字母)
(2)写出装置Ⅰ和Ⅱ中的实验现象:
Ⅰ中
Ⅱ中 .
(3)写出装置Ⅰ和装置Ⅱ中发生反应的方程式
Ⅰ中
Ⅱ中 .
(4)由强到弱排序三者的酸性顺序>>(填结构简式)
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中只含有Na+、Cl-、Fe3+、SO42-等四种离子,已知前三种离子的个数比为3:1:2,则溶液中Fe3+与SO42-的个数比( )
A. 1:2 B. 1:4 C. 3:4 D. 1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com