
科目: 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的位置如图所示,这四种元素的原子最外层电子数之和是24,下列说法中正确的是( )
X | Y | |
Z | W |
A. 原子半径:![]()
B. 最高价氧化物对应水化物的酸性:![]()
C. 四种元素的单质中,W单质的熔、沸点最高
D. X的气态氢化物可与它的最高价氧化物的水化物发生反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于元素周期表的叙述中正确的是( )
A.第IA族元素都是金属元素
B.第VIA族元素的单质在常温下均为气体
C.第二、三周期中的金属元素种类一 样多
D.短周期包括第一、二、三周期
查看答案和解析>>
科目: 来源: 题型:
【题目】如果将前18号元素按原子序数递增的顺序排列,可形成如图所示的“蜗牛”形状,图中每个“![]() ”代表一种元素,其中
”代表一种元素,其中![]() 点代表氢元素
点代表氢元素![]() 下列说法不正确的是( )
下列说法不正确的是( )

A. 最高价氧化物对应水化物的酸性![]() 比
比![]() 弱
弱
B. 最简单气态氢化物的稳定性![]() 比
比![]() 小
小
C. 金属性![]() 比
比![]() 弱
弱
D. 原子半径![]() 比
比![]() 大
大
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备。
①用肼(N2H4)作燃料,四氧化二氮作氧化剂,两者反应生成氮气和气态水。
已知:N2(g)+2O2(g)===N2O4(g) ΔH=+10.7 kJ·mol-1
N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-543 kJ·mol-1
写出气态肼和N2O4反应的热化学方程式:_______________________________。
②已知四氧化二氮在大气中或在较高温度下很难稳定存在,它很容易转化为二氧化氮。试推断出二氧化氮制取四氧化二氮的反应条件(或措施):_______________________。
(2)科学家制造出一种使用固体电解质的燃料电池,其效率更高,可用于航空航天。如图1所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO2固体,它在高温下能传导阳极生成的O2-离子(O2+4e-===2O2-)。

①c电极的名称为________,d电极上的电极反应式为__________________________。
②如图2所示为用惰性电极电解100 mL 0.5 mol·L-1CuSO4溶液,a电极上的电极反应式为____________。若a电极产生56 mL(标准状况)气体,则所得溶液的pH=______(不考虑溶液体积变化),若要使电解质溶液恢复到电解前的状态,可加入_____(填序号)。
a.CuO b.Cu(OH)2 c.CuCO3 d.Cu2(OH)2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】如表是部分短周期元素的原子半径及主要化合价,根据表中信息,叙述正确的是( )
元素代号 | L | M | R | T |
原子半径 |
|
|
|
|
主要化合价 |
|
|
|
|
A. R和T非金属性强弱比较:T > R B. L和M金属性强弱比较:M > L
C. ![]() 与
与![]() 的核外电子数相等 D. R单质在氧气中燃烧生成XO3
的核外电子数相等 D. R单质在氧气中燃烧生成XO3
查看答案和解析>>
科目: 来源: 题型:
【题目】在指定的条件下,下列各组离子一定能大量共存的是( )
A.无色的溶液中:Fe3+、K+、NO3﹣、Cl﹣
B.含有大量Ba2+的溶液中:NH4+、Na+、Cl﹣、H+
C.pH=13的溶液中:NH4+、Na+、SO42﹣、Cl﹣
D.c(H+)=0.1 molL﹣1的溶液中:K+、I﹣、Cl﹣、NO3﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组以水杨酸和甲苯为主要原料,按下列路线合成抗血栓药物﹣﹣新抗凝. 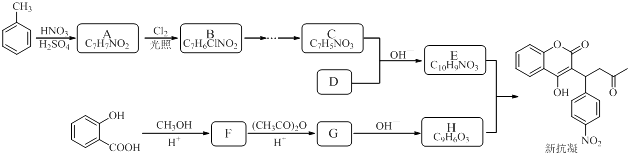
已知: ![]()
RCHO+CH3COR′ ![]() RCH═CHCOR′
RCH═CHCOR′
请回答:
(1)同时符合下列条件的A的所有同分异构体种.
①红光光谱标明分子中含有 ![]() 结构;
结构;
②1H﹣NMR谱显示分子中含有苯环,且苯环上有三种不同化学环境的氢原子.
(2)设计F→G的化学方程式 .
(3)下列说法不正确的是 .
A.化合物B能使Br2水褪色
B.化合物C能与新制氢氧化铜反应
C.化合物F能与FeCl3发生显色反应
D.新抗凝的分子式为C19H16O6
(4)写出化合物的结构简式:A .
(5)G→H的化学方程式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学将铁铝合金样品溶解后取样25.00mL,分离并测定Fe3+的浓度,实验方案设计如下: 
已知:乙醚[(C2H5)2O]是一种易挥发、易燃、有麻醉性的有机化合物,沸点为34.5度,微溶于水,在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚,当盐酸浓度降低时,该化合物解离.
请回答:
(1)操作A的主要仪器是 .
(2)经操作A后,为判断Fe3+是否有残留,请设计实验方案 .
(3)滴定前,加入的适量H2SO4 , 写出溶液中发生离子方程式 .
(4)滴定达到终点时,消耗0.0100 molL﹣1K2Cr2O7溶液6.00mL.根据该实验数据,试样X中c(Fe3+)为 .
(5)上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是(填一种) .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com