
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A. 1molCO2含有2mol 氧原子 B. 2molCO2含有2mol 氧原子
C. CO2的摩尔质量是44 D. 1molCO2的质量是44g·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于苯的叙述正确的是

A. 反应①为取代反应,有机产物与水混合浮在上层
B. 反应②为氧化反应,反应现象是火焰明亮并带有浓烟
C. 反应③为取代反应,有机产物是一种烃
D. 反应④中1 mol苯最多与3 mol H2发生加成反应,因为每个苯分子含有三个碳碳双键
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、及其化合物在生产中有重要应用。
(1)设反应 ① Fe(s) + CO2(g)![]() FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
FeO(s) + CO(g) ⊿H = Q1 平衡常数为K1
② Fe(s) + H2O(g)![]() FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
FeO(s) + H2(g) ⊿H = Q2 平衡常数为K2
不同温度下,K1、K2的值如下表
T/K | K1 | K2 |
973 | 1.47 | 2.38 |
1173 | 2.15 | 1.67 |
现有反应 ③ H2(g) + CO2(g)![]() CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
CO(g) + H2O(g) ⊿H = Q3,结合上表数据,根据反应①、②推导出Q1、Q2、Q3的关系式Q3=_____________,反应③是________(填“放”或“吸”)热反应。
(2)已知CO2催化加氢合成乙醇的反应原理为:2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ⊿H <0
C2H5OH(g)+3H2O(g) ⊿H <0
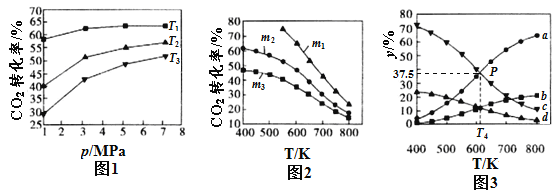
①图l、图2分别是CO2的平衡转化率随压强及温度的变化关系,已知m为起始时的投料比,即m=n(H2)/n(CO2),图l中投料比相同,温度从高到低的顺序为________,图2中m1、m2、m3从大到小的顺序为_____________。
②图3表示在总压为5MPa的恒压条件下,且m=3时,平衡状态时各物质的物质的量分数与温度的关系。则曲线d代表的物质为________(填化学式),T4温度时,该反应的平衡常数Kp=________。(提示:用平衡分压代替平衡浓度来计算,某组分平衡分压=总压×该组分的物质的量分数,结果保留小数点后三位)
查看答案和解析>>
科目: 来源: 题型:
【题目】铜、镁合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL 的NO2气体和336mL的N2O4气体(均为标准状况下),在反应后的溶液中加入足量的NaOH溶液,生成的沉淀的质量为( )
A.7.04g
B.8.26g
C.8.51g
D.9.02g
查看答案和解析>>
科目: 来源: 题型:
【题目】研究化学反应原理对于生产、生活及环境保护具有重要意义。请回答下列问题:
(1)常温下,物质的量浓度均为0.1 mol·L-1的四种溶液①NH4NO3 ②CH3COONa ③(NH4)2SO4 ④Na2CO3,pH从大到小排列顺序为_________________(填序号)。
(2)常温下,向20 mL 0.2 mol·L-1 H2A溶液中滴加0.2 mol·L-1 NaOH溶液。有关微粒物质的量变化如下图所示。
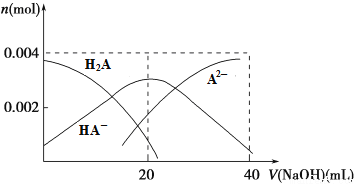
则当v(NaOH)=20 mL时,溶液中离子浓度大小关系:________,水的电离程度比纯水________(填“大”、“小”或“相等”)。
(3)含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol·L-1的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
①该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为________________________。
②若处理后的废水中残留的c(Fe3+)=2.0×10-13mol·L-1,则残留的Cr3+的浓度为___________。(已知:Ksp[Fe(OH)3)]=4.0×10-38, Ksp[Cr(OH)3]=6.0×10-31)
(4)利用“Na-CO2”电池将CO2变废为宝。我国科研人员研制出的可充电“ Na-CO2”电池,以钠箔
和多壁碳纳米管(MWCNT)为电极材料,总反应为4Na+3CO2 ![]() 2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:
2Na2CO3+C。放电时该电池“吸入”CO2,其工作原理如图所示:

①放电时,正极的电极反应式为_____________________________。
②若生成的Na2CO3和C全部沉积在电极表面,当转移0.2 mol e- 时,两极的质量差为______g。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组离子能大量共存的是( )
A.NH4+、Na+、NO3-、OH-B.Ca2+、Na+、Cl-、CO32-
C.K+、H+、SO42-、OH-D.Na+、K+、OH-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32﹣、SO42﹣、NO3﹣中的几种.①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示.则下列说法正确的是( ) 
A.溶液中的阳离子只有H+、Mg2+、Al3+可能含有Fe3+
B.溶液中一定不含CO32﹣和NO3﹣ , 一定含有SO42﹣
C.溶液中c(NH4+)=0.3 mol/L
D.c(H+):c(Al3+):c(Mg2+)=1:1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com