
科目: 来源: 题型:
【题目】关于生物体内有机化合物所含元素的叙述,错误的是( )
A. 叶绿素含有镁元素,血红蛋白含有铁元素
B. 脱氧核糖和ATP均含有磷元素
C. 甲状腺激素含有碘元素,不能为细胞供能
D. 胰岛素含有氮元素,能调节生命活动
查看答案和解析>>
科目: 来源: 题型:
【题目】铬是广泛存在于环境中的金属元素,在水体中主要以三价和六价铬的化合物为主,其中六价铬对人有害。通常含六价铬的酸性工业废水的处理流程为:
![]()
请回答下列问题:
I.(1)第①步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
Cr2O72-(橙色)+H2O,请写出该反应的平衡常数表达式K= ______________。第①步反应的下列状态一定达到平衡的是________。
a.Cr2O72-和CrO42-的浓度相同 b.2v (Cr2O72-) = v (CrO42-) c.溶液的颜色保持不变
(2)常温下,向100mL、0.1mol/L的K2CrO4溶液加入1mol/L硫酸10mL,存在平衡:
2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O K=5×1014
Cr2O72-(橙色)+H2O K=5×1014
若向上述溶液中加入浓KOH溶液,溶液的颜色由橙色渐变为黄色,反应逆转:Cr2O72-(橙色) +2OH-![]() 2CrO42-(黄色) +H2O
2CrO42-(黄色) +H2O
设该反应的平衡常数为K1,则K1=_______________。
II.为进一步研究初始pH和草酸浓度对第②步反应速率的影响,某学习小组设计对比实验如下表:
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
甲 | 4 | 60 | 10 | 30 |
乙 | 5 | x | 10 | 30 |
丙 | 5 | y | 5 | z |
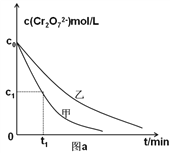
(3)实验设计表中z=_______mL;
(4)实验甲中0~t1时间段反应速率v(Cr3+)=________mol/(L·min) (用含字母的代数式表示)。
(5)常温下,第③步生成的Cr(OH)3在溶液中存在以下平衡:Cr(OH)3(s)![]() Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。
Cr3+(aq)+3OH-(aq),溶度积Ksp[Cr(OH)3]=1×10-32,要使c(Cr3+)不高于10-5mol/L,溶液的pH应调至___________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学在学习元素化合物知识的过程中,发现研究物质A可以通过以下的角度展开。其中A、B、C、D、E中均含甲元素。

请回答:
(1)若甲元素为短周期元素,单质D为黄色固体,A是氧化物。
① 甲元素在元素周期表中的位置是______。
② 氧化物A与少量NaOH溶液反应的离子方程式是______。
(2)若D为金属,A为盐,产物B遇KSCN溶液呈红色。
①下列说法正确的是______(填字母)。
a.单质D可以与足量盐酸、硝酸或硫酸等酸反应生成盐A
b.盐A与NaOH溶液反应时,产物在空气中不稳定,易被O2氧化
c.还原剂Y可选择铜
②若氧化剂X为酸性高锰酸钾溶液,5.6 g 单质D全部转化为产物B时,转移电子的物质的量为______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】某有机物在氧气中充分燃烧,生成CO2和H2O的物质的量之比为1:2,则该有机物
A.一定含有C、H、O三种元素B.分子中C、H原子个数之比为1:4
C.只含有C、H两种元素D.最简式为CH4
查看答案和解析>>
科目: 来源: 题型:
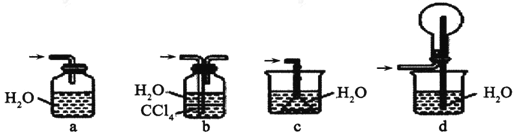
【题目】氨气是一种重要化合物,在工农业生产、生活中有重要作用。利用下图探究氨气的性质。
(1)收集气体,按下图玻璃装置进行实验。先打开旋塞①,B瓶中产生白色的烟,原因是______(用化学方程式表示);稳定后,关闭旋塞①,再打开旋塞②,B瓶中的现象是________。

(2)若将氯气和氨气在集气瓶中混合,会出现浓厚的白烟并在容器内壁凝结,另一生成物是空气的主要成分之一,请写出反应的化学方程式:________,该反应生成的还原产物的化学键类型是________。
(3)“氨的催化氧化”是工业生产硝酸的重要步骤。某化学课外活动小组设计了如下装置模拟该实验过程,并用水吸收制取硝酸(固定装置略去):

①A装置的分液漏斗中盛放浓氨水,则烧瓶中盛放的药品应该是_______。
②C装置中发生反应的化学方程式为________。
③反应后,装置E中除存在较多的H+外,还可能存在的一种离子是______,试设计实验证明这种离子的存在________。
④下列哪些装置可以同时起到装置D和E的作用_______ (填代号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某化工集团为了提高资源利用率减少环境污染,将钛厂、氯碱厂和甲醇厂组成产业链.其主要工艺如下:
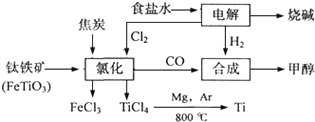
(1)写出钛铁矿经氯化法得到四氯化钛的化学方程式:_____________________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s);△H=﹣641kJmol﹣1
②Ti(s)+2Cl2(g)=TiCl4(s);△H=﹣770kJmol﹣1
则2Mg(s)+TiCl4(g)=2MgCl2(s)+Ti(s);△H=___________________________。反应2Mg+TiCl4![]() 2MgCl4+Ti在Ar气氛中进行的理由是_______________________。
2MgCl4+Ti在Ar气氛中进行的理由是_______________________。
(3)在上述产业链中,合成192t甲醇理论上需额外补充H2___________t(不考虑生产过程中物质的任何损失).
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池中负极上的电极反应式是_____________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com